Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
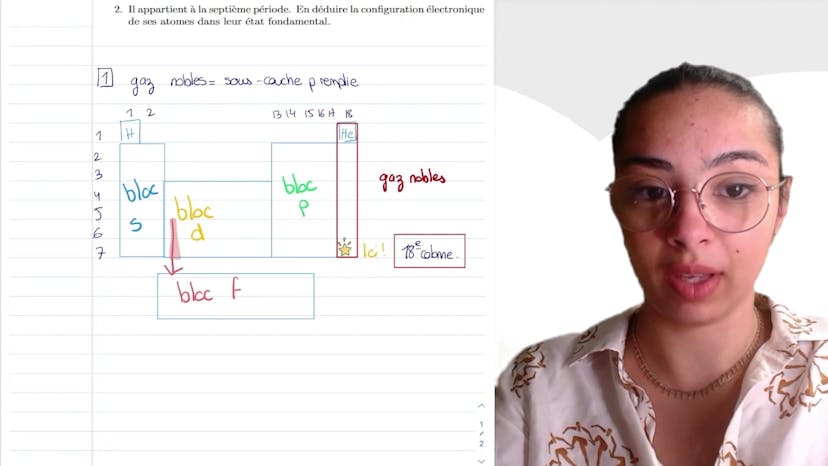
Quelques familles d'éléments
Aujourd'hui, dans ce cours sur les familles d'éléments chimiques, nous allons examiner différentes familles et leurs propriétés en termes de classification. Commençons par le calcium, qui appartient à la famille des alcalins terrestres. On nous demande de trouver l'ion monoatomique stable qu'il peut former. Pour cela, il faut se rappeler des différentes colonnes auxquelles correspondent les familles. Les alcalins terrestres se trouvent dans la deuxième colonne. Ils ont des propriétés physiques importantes. En général, les éléments ont besoin d'avoir la structure électronique d'un gaz noble pour être stables. Le calcium se trouve dans la première colonne, tandis que les gaz rares se trouvent dans la dix-huitième colonne. Ainsi, le calcium souhaite avoir la même configuration électronique qu'un gaz rare qui se trouve juste avant lui. Par conséquent, il aimerait perdre deux électrons pour obtenir cette configuration. Il forme donc l'ion Ca2+. Ensuite, nous avons l'iode, qui est un halogène. Les halogènes se trouvent dans l'avant-dernière colonne. Ils forment des ions I-. Pour nommer l'iode, on utilise le suffixe "-iodure" (comme pour les autres halogènes tels que le brome). Lorsqu'il s'agit de déterminer le nombre de liaisons que les atomes peuvent former pour s'entourer d'autres électrons de valence, il faut se référer aux schémas de Lewis pour la configuration des molécules. Dans ce cas, nous nous concentrons sur les atomes individuels. Les atomes forment des liaisons covalentes lorsqu'ils partagent des électrons pour atteindre la structure électronique d'un gaz rare. L'hydrogène a un électron de valence et aimerait en avoir deux pour atteindre la structure de l'hélium. Il forme donc une seule liaison. Le carbone a quatre électrons de valence et souhaite en avoir huit. Il forme donc quatre liaisons pour atteindre cet objectif. L'azote a cinq électrons de valence et aimerait en avoir huit. Il forme donc trois liaisons. Enfin, le chlore a sept électrons de valence et aimerait en avoir huit. Il forme donc une liaison ou gagne un électron pour devenir un ion chlorure. J'espère que cette transcription vidéo vous a été utile. N'hésitez pas à poser vos questions en commentaire.