Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
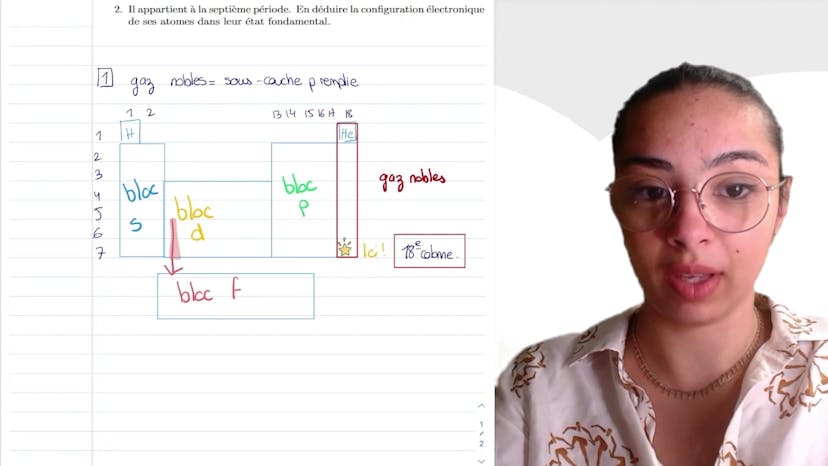
Encore des configurations électroniques
Dans cette vidéo, Leïla explique comment déterminer les configurations électroniques de l'aluminium, du titanium et du préséodyme dans leur état fondamental.
Elle rappelle les règles pour déterminer les configurations électroniques: la règle de Schlickowski qui dit que les couches sont remplies selon l'ordre croissant de n plus l, et en cas d'égalité, selon n croissant, et le principe de Pauli qui dit que deux électrons ne peuvent pas être décrits par le même quadruplet de nombres quantiques.
Elle donne les configurations électroniques suivantes:
- Aluminium: 1s2 2s2 2p6 3s2 3p1
- Titanium: 1s2 2s2 2p6 3s2 3p6 4s2 4d2
- Préséodyme: 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f3
Elle explique ensuite la répartition des électrons dans les sous-couches non saturées, en utilisant la règle de Hund qui dit que les électrons occupent un maximum d'orbitales atomiques avant de s'apparier si les orbitales sont dégénérées. Les orbitales sont dégénérées si elles sont au même niveau d'énergie.
Elle donne les répartitions suivantes:
- Pour l'aluminium: 3p1 avec un seul électron
- Pour le titanium: 4d2 avec un électron dans chaque orbitale
- Pour le préséodyme: 4f3 avec un électron dans chaque orbitale, et une paire d'électrons appariés dans une orbitale
Elle conclut en disant que ces connaissances sont utiles pour les devoirs surveillés et encourage les spectateurs à poser des questions dans les commentaires.