Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
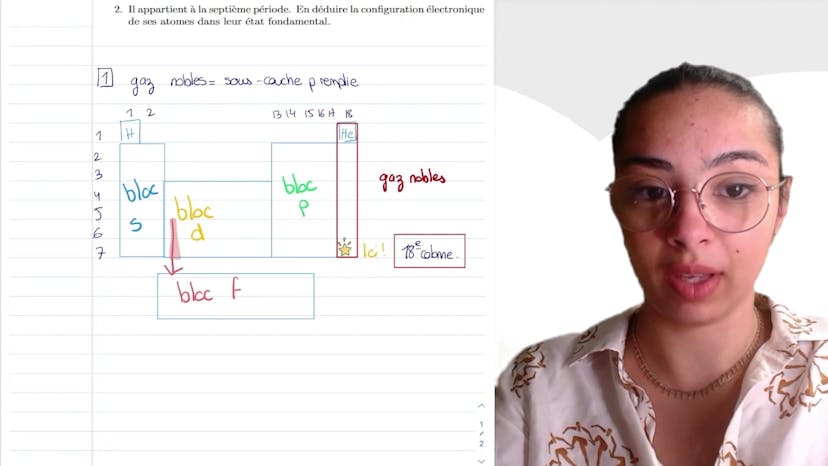
L'oxygène
L'oxygène et l'azote ont les configurations électroniques suivantes : 1s² 2s² 3p4 et 1s² 2s² 3p3 respectivement. Les énergies de première et de seconde ionisation sont spécifiques à chaque élément. La première ionisation consiste à arracher le premier électron d'un atome, tandis que la deuxième ionisation consiste à arracher le deuxième électron. Contrairement à ce que l'on pourrait penser, la deuxième ionisation ne se fait pas en une seule fois, mais par étapes. Les atomes de lithium, de bore et d'oxygène présentent des singularités dans leurs énergies d'ionisation. Par exemple, le lithium atteint une grande stabilité avec sa configuration électronique de Li+, ce qui rend l'arrachement du deuxième électron difficile et donc rend Li2+ moins stable. De manière similaire, le bore et l'oxygène ont des énergies d'ionisation spécifiques en raison de leurs configurations électroniques. Ces exemples illustrent que la stabilité des ions dépend de leurs configurations électroniques.