Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Le sel d’oseille (2)
Dans cette vidéo, nous terminons le sujet sur les diacides qui est tombé l'année dernière en Polynésie dans l'exercice sur les sels d'ozaïque. Dans la vidéo précédente, nous avons étudié l'acide oxalique et avons invalidé l'hypothèse selon laquelle il s'agirait d'un diacide fort. Nous formulons donc une nouvelle hypothèse selon laquelle l'acide oxalique est en réalité un monoacide faible en solution.
Nous donnons les concentrations d'acide apporté et son pKa, ainsi que la réaction associée. Nous remarquons que cette réaction présente des doubles flèches, ce qui indique qu'il s'agit d'une dissociation partielle en équilibre. Nous rappelons que le pH de la solution réalisée est de 1,47, ce qui servira de preuve pour valider ou invalider notre hypothèse.
Nous devons également écrire l'équation modélisée de la transformation chimique de l'espèce AH- avec l'eau. Cette réaction est classique et produit un proton et une forme hydratée (H3O+).
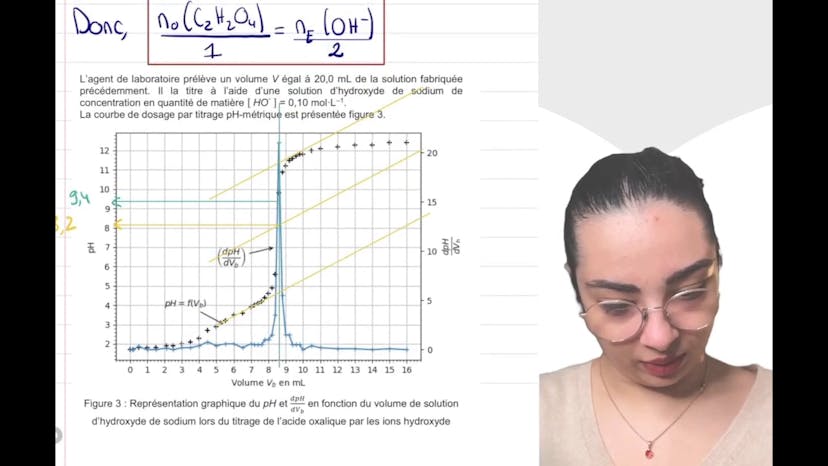
En utilisant la figure 1, nous déterminons le pKa de la deuxième acidité de l'acide oxalique. En nous plaçant au point d'intersection de la courbe de distribution théorique, nous trouvons un pH égal à environ 4,3, ce qui correspond au pKa recherché.
En utilisant la figure du pH réel, nous donnons une estimation approximative du pourcentage de chaque espèce présente dans la solution. Nous constatons que la concentration de A2- est négligeable et pouvons donc considérer que l'acide oxalique se comporte comme un monoacide.
Nous exprimons ensuite la constante d'acidité K1 en fonction des concentrations des espèces à l'équilibre. Nous utilisons le quotient réactionnel de la réaction et l'activité de l'eau pour cela.
Nous devons également justifier la concentration en oxonium notée H et vérifier une équation du second degré donnée. En utilisant un tableau d'avancement, nous exprimons les concentrations de chaque espèce en fonction de H et utilisons la constante de réaction KA1 pour établir l'équation du second degré.
Enfin, nous utilisons un code Python pour calculer la valeur de KA1 et constatons que le pH final calculé est très proche du pH expérimental, ce qui confirme notre hypothèse selon laquelle l'acide oxalique se comporte comme un monoacide faible.
En conclusion, cette vidéo nous a permis de terminer notre étude sur les diacides et de valider l'hypothèse selon laquelle l'acide oxalique se comporte comme un monoacide faible.