 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Corrigés de BAC
Bac Physique-Chimie
Terminale

La mission Grace-Fo (1)
Dans cette vidéo, Théobald de Studio explique la caractérisation de l'orbite d'un satellite dans le cadre de la mission GRAFO, qui envoie deux satellites jumeaux situés sur la même orbite. Il mentionne que l'attraction gravitationnelle de la planète varie faiblement d'un mois à l'autre en raison d'une infime fraction de la masse terrestre en mouvement. Dans la première partie de la vidéo, il se concentre sur la caractérisation de l'orbite des satellites de cette mission, qui est quasi-circulaire avec une altitude de 490 km et une inclinaison de 89° par rapport à l'équateur.
Il explique ensuite les forces qui s'appliquent sur les satellites. En se concentrant uniquement sur le mouvement d'un satellite, il présente le schéma de la Terre avec le satellite situé sur son orbite à une distance L de ce dernier. Il poursuit en donnant l'expression vectorielle de la force gravitationnelle exercée par la Terre sur le satellite, qui s'exprime par G * masse de la Terre * masse du satellite / distance Terre-satellite au carré, portée par un vecteur unitaire dirigé du satellite vers la Terre.
Il en déduit ensuite l'expression du champ vectoriel terrestre, qui est égal à G * masse de la Terre * masse du satellite / (rayon de la Terre + altitude du satellite) au carré, porté par le vecteur unitaire dirigé du satellite vers la Terre.
En considérant uniquement l'action de la Terre, il établit l'expression vectorielle de l'accélération du satellite en utilisant le principe fondamental de la dynamique. Il obtient que l'accélération du satellite est égale au champ gravitationnel terrestre.
Il montre ensuite que dans le cadre de l'approximation d'une orbite circulaire, le mouvement du satellite est uniforme. Il explique que dans un mouvement circulaire, l'accélération peut être décomposée en une composante tangentielle et une composante normale. En utilisant cette décomposition, il démontre que l'accélération tangentielle est nulle, ce qui signifie que la vitesse du satellite est constante et donc que son mouvement est circulaire uniforme.
Il conclut cette partie de la vidéo en invitant les spectateurs à poser leurs questions en commentaire.
Corrigés de BAC
Bac Physique-Chimie
Terminale

La mission Grace-Fo (2)
Dans ce cours, nous étudions le mouvement d'un satellite autour de la Terre. Nous démontrons que la vitesse du satellite peut être exprimée par la relation GMt/RT+Z. Nous calculons ensuite la période de révolution du satellite, qui est d'environ 1h34. En utilisant cette période, nous déterminons que le satellite fait environ 15 tours de la Terre en une journée.
Ensuite, nous étudions deux satellites, où le premier passe au-dessus d'une zone où le champ gravitationnel n'est pas centripète, contrairement au deuxième satellite. Nous démontrons que la distance entre les deux satellites augmente, car le deuxième satellite est soumis à un mouvement circulaire uniforme, tandis que le premier subit un mouvement circulaire accéléré. En conséquence, la distance entre les deux satellites augmente.
Corrigés de BAC
Bac Physique-Chimie
Terminale

La mission Grace-Fo (3)
Dans cette vidéo, Théobald de Studio explique le principe de l'interféromètre embarqué utilisé dans la mission GRASFO. Deux satellites jumeaux sont envoyés sur la même orbite pour mesurer leur distance et analyser les variations du champ gravitationnel autour de la Terre. L'interféromètre fonctionne en envoyant un laser sur un miroir semi-réfléchissant. Les interférences observées permettent de calculer la distance entre les deux satellites. La cohérence des sources est assurée par le miroir semi-réfléchissant, qui sépare le faisceau laser en deux. La différence de marche, qui correspond à la différence de distance parcourue par les deux faisceaux, peut être calculée à partir du schéma du dispositif. La variation de la différence de marche, delta d, est égale à 2d lorsque le satellite 1 s'éloigne du satellite 2. La détectabilité maximale du détecteur d'interférence correspond à une variation de différence de marche égale à λ/2, où λ est la longueur d'onde de la lumière utilisée. Ainsi, la plus petite variation de distance détectable par l'interféromètre est de 532 nanomètres.
Corrigés de BAC
Bac Physique-Chimie
Terminale

La mission Grace-Fo (4)
Dans cette vidéo, Théobald de Studio explique le fonctionnement d'un accéléromètre utilisé dans le cadre d'une mission de Grasse-Faux pour mesurer le champ gravitationnel terrestre. L'accéléromètre utilise une masse d'épreuve placée au centre d'une cage électrostatique qui subit un déplacement en réponse à une force non gravitationnelle. Ce déplacement modifie la capacité des condensateurs du dispositif. L'étude se concentre sur un condensateur plan dont l'armature mobile est constituée par la face gauche de la masse d'épreuve. En l'absence de force non gravitationnelle, la capacité du condensateur est définie par la formule C = Y0S / (E + X), où Y0 est la permittivité électrique du vide, S est la surface en regard des armatures, E est la distance entre les armatures et X est le déplacement de la masse mobile. On observe donc une relation inverse entre le déplacement X et la capacité C. En ce qui concerne le champ électrique, il est déterminé par E = U / (E + X), où U est la tension appliquée entre les armatures du condensateur plan. L'armature mobile est soumise au champ E1 créé par l'armature fixe, et les lois de l'électrostatique montrent que E1 = E / 2. Ainsi, l'armature mobile subit une force F opposée à E. Parmi les quatre schémas donnés, le schéma 2 correspond à la représentation correcte du champ électrique E et de la force électrique F. Enfin, dans un dernier exercice, on nous présente un dispositif où la masse d'épreuve est mobile entre deux armatures fixes opposées. Les forces électrostatiques exercées par les armatures fixes se compensent, ce qui conduit à l'égalité des champs électriques à droite et à gauche, soit ED = EG.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Protection des fondations en acier des éoliennes en mer (1)
Dans cette vidéo, Théobald de Studio parle de la protection des éoliennes en mer contre la corrosion. Il explique qu'il y a deux principales méthodes de protection : l'utilisation d'une anode sacrificielle en aluminium, qui corrode à la place du fer, ou l'utilisation d'une protection par courant imposé. L'exercice se concentre sur la protection cathodique avec une anode sacrificielle en aluminium.
L'objectif de l'exercice est de vérifier si, en milieu oxydant, le fer peut être protégé de l'oxydation en étant en contact électrique avec de l'aluminium. Pour cela, une expérience est réalisée : une plaque d'aluminium est mise en contact avec une solution de sulfate d'aluminium, et une plaque de fer est mise en contact avec une solution de chlorure de fer. Les deux plaques sont reliées par un fil électrique pour former une pile.
On demande ensuite d'exprimer le quotient de réaction initial associé à cette réaction. Le quotient de réaction est calculé en utilisant les concentrations des ions Al3+ et Fe2+ et les coefficients stoichiométriques de la réaction.
La valeur du quotient de réaction initiale est calculée et comparée à la constante d'équilibre de la réaction. Si le quotient de réaction est inférieur à la constante d'équilibre, la réaction se fait dans le sens direct. Dans ce cas, la réaction va se faire dans le sens direct.
En utilisant les résultats précédents, Théobald déduit la réaction qui se passe à l'électrode d'aluminium. Il explique que l'aluminium solide réagit pour former des ions Al3+ et des électrons, ce qui est cohérent avec les observations expérimentales.
Ensuite, l'électrode qui joue le rôle de l'anode dans la pile est identifiée comme étant l'électrode d'aluminium, car elle subit une oxydation en cédant des électrons.
La prochaine vidéo abordera le sujet de la protection de l'éolienne et de la quantité d'aluminium nécessaire. Théobald encourage les spectateurs à poser des questions dans les commentaires.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Protection des fondations en acier des éoliennes en mer (2)
Dans cette vidéo, Oval2Studio explique comment calculer la masse d'aluminium nécessaire pour protéger complètement les éoliennes en air. Il est expliqué que l'aluminium réagit préférentiellement avec le dioxygène dissous dans l'eau, ce qui en fait le matériau idéal pour la protection cathodique des éoliennes. L'équation de réaction chimique entre l'aluminium et le dioxygène dissous est présentée, ainsi que les demi-équations correspondantes à chaque couple redox. En égalisant le nombre d'électrons échangés dans chaque demi-équation, on peut ensuite obtenir l'équation de réaction finale.
Ensuite, il est mentionné qu'une protection efficace correspond à un courant électrique d'intensité de 400 A. Pour calculer la masse d'aluminium nécessaire pour une durée de 25 ans, on utilise la relation entre l'intensité du courant électrique et la capacité électrique de la pile. On sait que pour chaque capacité électrique, on échange deux électrons, ce qui permet de relier le nombre d'électrons à la quantité de matière d'aluminium. En utilisant la masse molaire de l'aluminium, on peut alors calculer la masse d'aluminium nécessaire.
Le résultat numérique obtenu est de 2,9 x 10^4 kilogrammes d'aluminium, ce qui représente une quantité énorme. Cependant, le constructeur a choisi une autre solution pour la protection des éoliennes, en raison des coûts élevés associés à une telle quantité d'aluminium, ainsi que de l'impact environnemental de la libération d'ions aluminium dans la mer.
En conclusion, ce cours explique comment déterminer la masse d'aluminium nécessaire pour protéger les éoliennes en air, et présente les raisons pour lesquelles le constructeur a choisi une solution alternative.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Additif alimentaire pour les agneaux (1)
Dans cette vidéo, on se focalise sur un exercice de chimie ayant pour sujet le titrage par suivi conductimétrique. Cet exercice concerne les additifs alimentaires pour les agneaux, notamment le chlorure d'ammonium utilisé pour prévenir les maladies liées à la consommation excessive de céréales et de protéagineux.
Dans cet exercice, un éleveur administre quotidiennement un litre d'une solution de chlorure d'ammonium à un agneau de 24 kg, préparée par ses soins. L'objectif est de vérifier si la préparation de l'éleveur est conforme aux recommandations du site des partenaires de la production aux villes en France.
Un titrage conductimétrique est effectué en utilisant 10,00 ml de la solution préparée par l'éleveur diluée avec un volume d'eau distillée. La solution titrante utilisée est de l'hydroxyde de sodium (NaOH). La réaction chimique impliquée est celle entre le chlorure d'ammonium (NH4+) et l'hydroxyde de sodium (NaOH), qui donne de l'ammoniac (NH3) et de l'eau (H2O). Cette réaction est classée comme une réaction acido-basique étant donné l'échange de protons (H+) entre les réactifs.
En ce qui concerne le dispositif de titrage conductimétrique, un schéma est proposé avec une béchamel contenant la solution titrée, une burette graduée contenant la solution titrante, une sonde reliée à un conductimètre, et une autre sonde attachée à une potence avec un agitateur magnétique. Il est indiqué que le volume à l'équivalence est d'environ 14 mL, qui est déterminé en traçant la courbe conductimétrique obtenue à la fin du titrage.
Pour calculer la concentration en quantité de matière de la solution préparée par l'éleveur, il est utilisé l'équation de titration. Étant donné que les réactifs sont introduits en proportion stoichiométrique à l'équivalence, le nombre de moles de chlorure d'ammonium (NH4+) est égal au nombre de moles de l'hydroxyde de sodium (NaOH) à l'équivalence. En utilisant les concentrations et les volumes associés, l'expression de la concentration est trouvée. Il est précisé que la dilution de la solution titrée ne change rien et ne doit pas être prise en compte dans les calculs.
Ensuite, l'incertitude de la concentration obtenue est discutée. Il est proposé d'encadrer la concentration de la solution préparée par l'éleveur en utilisant les valeurs d'incertitude absolue données pour différents instruments de mesure (burette, pipette jaugée, éprouvette graduée). Étant donné la précision et la précision de mesure du volume VA (10,00 ml), il est conclu qu'une pipette jaugée a probablement été utilisée pour prélever ce volume. L'incertitude absolue sur ce volume est calculée et utilisée pour déterminer l'incertitude absolue sur la concentration.
Enfin, il est demandé de calculer la masse de chlorure d'ammonium donnée quotidiennement à l'agneau par l'éleveur et de comparer ce résultat à la valeur préconisée par le site des partenaires de la production aux villes en France. En utilisant la quantité de matière, la masse molaire et le volume (1 L) donnés, la masse est calculée. Il est constaté que la masse (7,5 g) est conforme à l'intervalle de valeurs préconisé par le site pour un agneau de 24 kg.
Pour toute question, il est invité à les poser en commentaire et le contenu se termine en annonçant une prochaine vidéo.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Additif alimentaire pour les agneaux (2)
Dans cette vidéo, Théobald de Studio parle du code Python nécessaire pour simuler un titrage par conductimétrie. Il explique qu'il s'agit d'un exercice dans lequel un éleveur donne des compléments alimentaires à son agneau et on veut vérifier si ces compléments sont cohérents. On effectue donc un titrage pour évaluer la concentration de la solution donnée à l'agneau.
La première question consiste à compléter le code à écrire aux lignes 6, 7 et 8, qui correspondent aux nombres stoichiométriques des espèces. A, B et C représentent respectivement les nombres stoichiométriques de NH4+, HO- et NH3+. Puisqu'ils sont tous égaux à 1 dans l'équation de réaction, on les définit tous comme 1.
Ensuite, on demande d'identifier les deux espèces chimiques correspondantes aux variables NSA et NSB. On constate que NSA est égal à la quantité de matière initiale de NH4+ ou de Cl-, alors que NSB est égal à la quantité de matière de Na+ versé dans la solution. Cela signifie que NSA représente la quantité de matière de Cl- et NSB représente la quantité de matière de Na+ en cours de réaction.
On nous présente ensuite cinq graphiques représentant l'évolution de la quantité de matière des différentes espèces chimiques en fonction du volume de solution titrante versé. Pour déterminer quel graphique correspond à quelle espèce chimique, on utilise un tableau de présence des espèces chimiques avant et après l'équivalence. On observe que la concentration de HO- augmente avant l'équivalence, que la quantité de matière de NH4+ diminue, que la quantité de matière de Na+ augmente, que la quantité de matière de Cl- reste constante et que la quantité de matière de NH3 augmente et reste constante après l'équivalence. On peut donc attribuer chaque graphique à l'espèce chimique correspondante.
Enfin, on nous demande de compléter le code aux lignes 12 et 19. À la ligne 12, on cherche le volume à l'équivalence en utilisant la formule CAVA/CB. À la ligne 19, on calcule Nb en utilisant la formule CAVA-CBVB. On conclut que A représente NH4+ et B représente HO-.
C'est ainsi que se termine cet exercice. N'hésitez pas à poser vos questions en commentaire et à attendre la prochaine vidéo.
Corrigés de BAC
Bac Physique-Chimie
Terminale
Analyse d’un pigment à base d’oxyde de fer (1)
Dans cette vidéo, nous nous intéressons à l'analyse d'un pigment à base d'oxyde de fer. Un pigment est une espèce chimique colorante et insoluble dans le milieu qu'elle colore. Dans cet exercice, nous analysons une poudre colorante contenant un pigment d'oxyde de fer de formule Fe2O3.
Le fabricant indique que la teneur en oxyde de fer de cette poudre est de 5%. Nous allons donc réaliser une analyse quantitative de ce produit en utilisant un dosage par étalonnage.
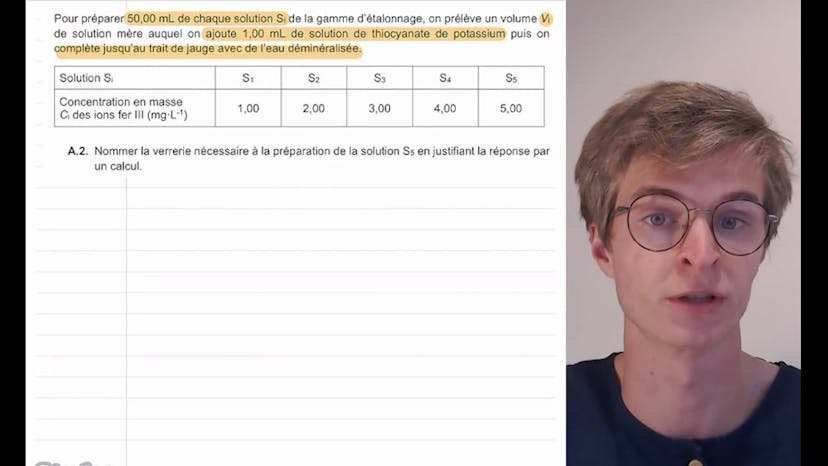
Dans la première étape, nous préparons une gamme d'étalons contenant des ions fer 3. Nous réalisons ensuite une courbe d'étalonnage à partir des mesures spectrophotométriques sur des solutions de concentration connue. Enfin, nous effectuons la préparation et l'analyse de l'échantillon.
Dans la partie A de l'exercice, nous préparons une gamme d'étalons à partir de la solution mère S0, qui contient les ions fer 3 en milieu acide à une concentration de 25,0 mg par litre. Pour cela, nous dissolvons du chlorure de fer 3 exahydraté solide de formule FECL3-6H2O. L'équation de dissolution de ce chlorure de fer 3 exahydraté est la suivante : FECL3-6H2O → FE3+ + 3CL- + 6H2O.
Pour déterminer la masse de soluté nécessaire à l'obtention de la solution S0, nous utilisons la quantité de matière en ion fer 3. Cette quantité de matière est égale à la concentration massique multipliée par le volume de la solution, divisée par la masse molaire des ions fer 3.
Dans la partie B de l'exercice, nous préparons différentes solutions SI de la gamme d'étalonnage en diluant la solution mère avec de l'eau déminéralisée et en ajoutant de la solution de thiocyanate de potassium. La masse de solution mère à prélever pour la préparation de la solution S5 est calculée en utilisant la conservation de la quantité de matière et de la masse lors d'une dilution.
Dans la partie C de l'exercice, nous réalisons un spectre d'absorption d'une solution de fer 3 en présence de thiocyanate. La couleur de la solution est déterminée en trouvant la longueur d'onde du maximum d'absorption et en prenant la couleur complémentaire. La longueur d'onde lambda0 la plus adaptée pour effectuer les mesures d'absorbance est également indiquée.
Si vous avez des questions, n'hésitez pas à les poser en commentaire et nous y répondrons avec plaisir.
Corrigés de BAC
Bac Physique-Chimie
Terminale
Analyse d’un pigment à base d’oxyde de fer (2)
Dans cette vidéo, Théobald de Cidéo aborde l'analyse d'un pigment à base d'oxyde de fer. Le pigment a une espèce chimique colorante insoluble dans le milieu qu'elle colore. L'objectif est de vérifier la teneur en oxyde de fer annoncée par le fabricant, qui affirme que la poudre contient 5% d'oxyde de fer.
La première partie de l'exercice consiste en la préparation d'une gamme étalon contenant des ions de fer. Ensuite, une courbe d'étalonnage est réalisée à l'aide de mesures spectrophotométriques pour établir la relation entre l'absorbance et la concentration molaire. Cette courbe d'étalonnage est compatible avec la loi de Berlembert, selon laquelle l'absorbance est proportionnelle à la concentration.
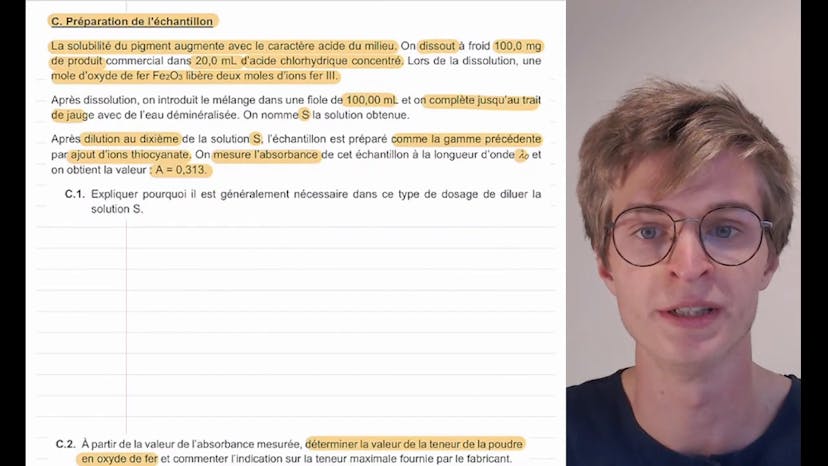
La deuxième partie de l'exercice concerne la préparation de l'échantillon. Il est mentionné que la solubilité du pigment augmente avec le caractère acide du milieu. Ainsi, 100 mg de produit sont dissous à froid dans 20 mg d'acide chlorhydrique concentré pour augmenter la solubilité du pigment. Le mélange est ensuite dilué et une fiole de 100 mg est complétée avec de l'eau déminéralisée. La solution obtenue est notée S.
Dans la troisième partie de l'exercice, la solution S est diluée au dixième pour préparer l'échantillon. L'absorbance de l'échantillon est mesurée à la longueur d'onde lambda0, et on obtient une valeur de 0,313.
Il est expliqué que la dilution de la solution S est nécessaire car la loi de Berlembert s'applique généralement aux solutions diluées. En utilisant la relation entre l'absorbance et la concentration massique en fer, la valeur de la teneur en oxyde de fer dans la poudre peut être déterminée. Le calcul est effectué en remontant les étapes : concentration massique en fer 3 dans l'échantillon, concentration massique en fer 3 dans la solution S, quantité d'ion fer dans la solution S, quantité de matière en oxyde de fer, et enfin la teneur en oxyde de fer dans la poudre.
Après les calculs, il est conclu que la teneur en oxyde de fer de la poudre est de 5,1%, ce qui est conforme à l'annonce du fabricant qui indiquait une teneur de 5%.
Cet exercice permet de comprendre comment réaliser un dosage par étalonnage et de vérifier les assertions d'un fabricant en utilisant des mesures spectrophotométriques.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le lancer de gerbe de paille (1)
Aucun résumé n'est disponible pour cette vidéo
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le lancer de gerbe de paille (2)
Le cours aborde le sujet du microphone utilisé lors de la compétition du lancé de gerbe de paille. Le microphone est un transducteur électro-acoustique qui convertit un signal acoustique en un signal électrique. Il est relié à une enceinte acoustique par l'intermédiaire d'un amplificateur de puissance. Le condensateur présent dans le microphone est constitué de deux armatures : une membrane mobile en plastique recouverte d'une fine pellicule métallique et une plaque métallique fixe. Lorsque le microphone ne capte pas de son, la distance entre les deux armatures est de l'ordre de 15 à 25 micromètres. Pour fonctionner, le condensateur doit être chargé avec une source de tension continue. On étudie la phase de charge du condensateur. On établit la relation entre la tension de la source de tension idéale (E), la tension aux bornes du condensateur (UC) et la tension aux bornes de la résistance (UR) en utilisant la loi des mailles. Ensuite, on montre que l'équation différentielle vérifiée par la tension aux bornes du condensateur lors de la charge est de la forme E = RC * (d(UC)/dt) + UC. On mesure la tension aux bornes du condensateur lors de sa charge et on obtient une courbe qui peut être modélisée par trois fonctions mathématiques. On argumente que la troisième fonction correspond à la modélisation de la charge du condensateur en se basant sur les limites des fonctions. On vérifie que la fonction retenue est solution de l'équation différentielle établie précédemment. Ensuite, on utilise la relation entre la capacité d'un condensateur plan et les armatures pour déterminer la valeur de la distance entre les deux armatures du microphone lorsque celui-ci ne capte pas de son. Enfin, on explique que lorsque la distance entre les armatures diminue, la capacité du condensateur diminue également.


