Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Volume dans une seringue
Dans cette vidéo, nous abordons le chapitre des fondements de la thermodynamique. Nous commençons par examiner le cas d'une seringue dans laquelle nous comprimons l'air avec un piston. Au départ, la pression est égale à la pression atmosphérique, soit 1 bar. L'air est considéré comme un gaz parfait à température constante. Le problème consiste à déterminer la pression finale lorsque le volume est réduit de 90%.
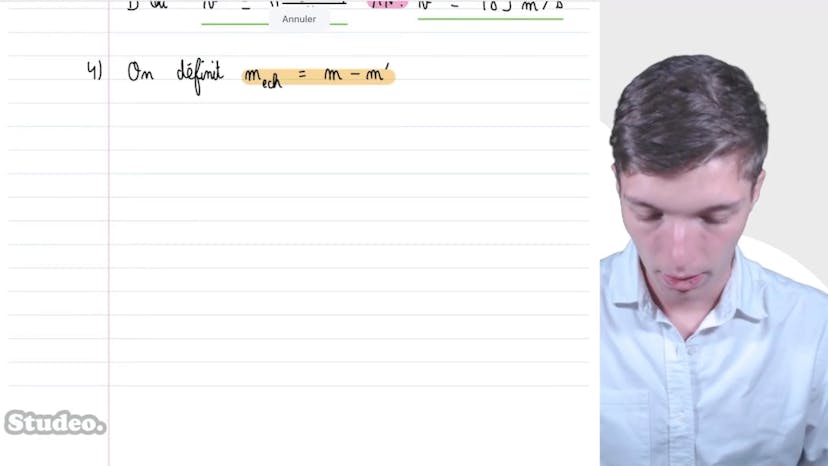
Pour résoudre ce problème, nous devons choisir le système sur lequel appliquer les théorèmes de la thermodynamique. Dans ce cas, le système est l'air à l'intérieur de la seringue, avec une pression initiale de V1, un volume de V1, une température de T, et une quantité de matière Na. Nous pouvons utiliser l'équation d'un gaz parfait, P1V1 = NaRT, pour lier ces variables d'état.
En réduisant le volume de 90%, nous posons un défi pour déterminer les nouvelles variables d'état, P2, V2, T et Na. Comme la transformation est à température constante et qu'il n'y a pas de fuite d'air, T et Na restent les mêmes que dans l'état initial. En utilisant de nouveau l'équation d'état du gaz parfait, P2V2 = NaRT, nous pouvons résoudre le problème.
En utilisant les deux équations d'état, nous trouvons que P2V2 = P1V1, et en supposant que V2 = 0,1V1, nous pouvons conclure que P2 = 10P1. En effectuant le calcul, nous obtenons une pression finale de 10 bars pour cette transformation.
Dans la deuxième question, nous cherchons à obtenir une pression de 2,5 bars. En utilisant à nouveau l'équation P2V2 = P1V1, nous trouvons que le rapport V2/V1 est égal à P1/P2. Nous pouvons alors déduire que pour obtenir une pression finale de 2,5 bars, le volume doit être réduit de 60%.
En concluant, nous pouvons constater que l'utilisation de l'équation d'état du gaz parfait nous permet de résoudre ces problèmes thermodynamiques. En fixant les valeurs de Na, R et T, nous pouvons observer que la pression varie inversement avec le volume. Cette méthodologie nous permet de résoudre ces problèmes plus facilement.
Merci d'avoir suivi cette vidéo et à bientôt !