Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Température d'ébullition
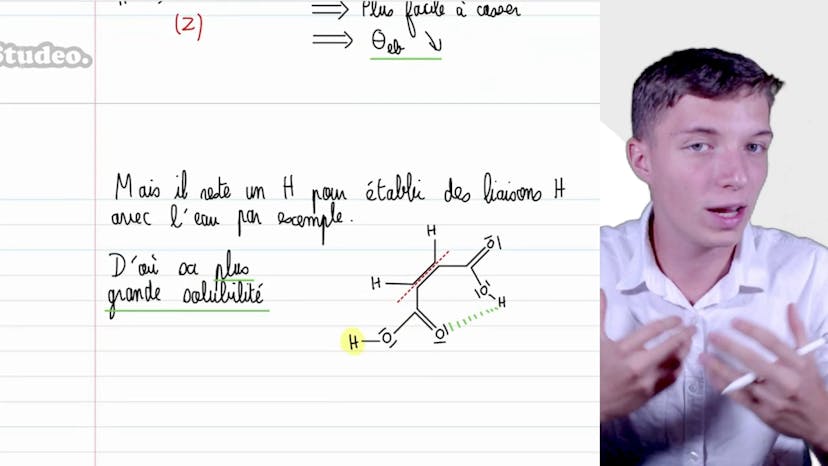
Dans cette vidéo, nous étudions le lien entre les interactions moléculaires et la température d'ébullition de certains composés. Nous comparons les propriétés du propane, de l'éthanamine et de l'éthanol, notamment leur masse molaire, leur moment dipolaire et leur température d'ébullition. Pour interpréter ces températures, il faut comprendre la notion d'ébullition, qui correspond au passage de l'état liquide à l'état gazeux. Cela nécessite de rompre les liaisons entre les molécules, ce qui demande de l'énergie. Plus les interactions entre les molécules sont fortes, plus il faudra d'énergie pour les rompre, ce qui se traduit par une température d'ébullition plus élevée. Nous nous intéressons aux interactions de type Van der Waals, en particulier les interactions de London et les liaisons hydrogènes. Le propane, une molécule apolaire, présente des interactions faibles de London, ce qui lui confère une faible température d'ébullition. L'éthanamine, une molécule polaire avec des liaisons hydrogènes, nécessite plus d'énergie pour rompre ces interactions et a donc une température d'ébullition plus élevée. L'éthanol, avec un moment dipolaire encore plus important et des interactions de quissomme plus fortes, a la température d'ébullition la plus élevée. Il est important de tenir compte de ces caractéristiques moléculaires lors de l'analyse des températures d'ébullition.