Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
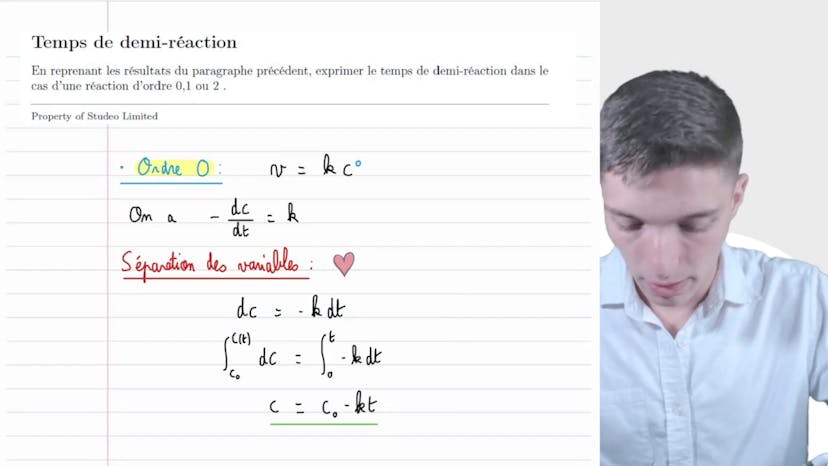
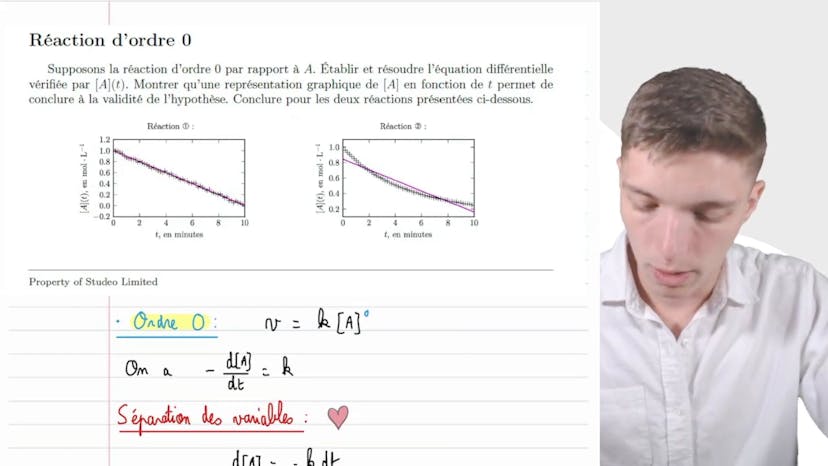
Energie d'activation
Dans cette vidéo, Matisse de Studio explique comment calculer l'énergie d'activation d'une réaction chimique en utilisant la formule d'Arenus. Il commence par expliquer que la vitesse de réaction double lorsque la température passe de 300 Kelvin à 400 Kelvin. Il fait l'hypothèse que la constante de vitesse double également. En utilisant la loi d'Arenus, il montre que la constante de vitesse est égale à A multiplié par l'exponentielle de moins EA/RT, où EA représente l'énergie d'activation, A est un facteur pré-exponentiel, R est la constante des gaz parfaits et T est la température de réaction. Sachant que la constante de vitesse double, il nomme K1 et K2 les constantes de vitesse pour les réactions réalisées à 300 Kelvin et 400 Kelvin respectivement. En utilisant la loi d'Arenus, il établit l'équation K2 = 2K1. En simplifiant l'équation, il isole l'énergie d'activation EA et trouve que EA est égal à R ln 2 divisé par 1/T1 - 1/T2. Il conclut que l'énergie d'activation de la réaction est de 6,9 kJ/mol. Il conseille de prendre son temps pour comprendre l'énoncé, donner des noms aux variables et utiliser la formule d'Arenus pour résoudre l'exercice.