Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Temps de demi réaction
Dans cette vidéo, Mathis de Studio traite des différents temps de demi-réaction pour les réactions d'ordre 0, 1 et 2. Il explique que ces notions sont essentielles à connaître pour les examens et les exercices.
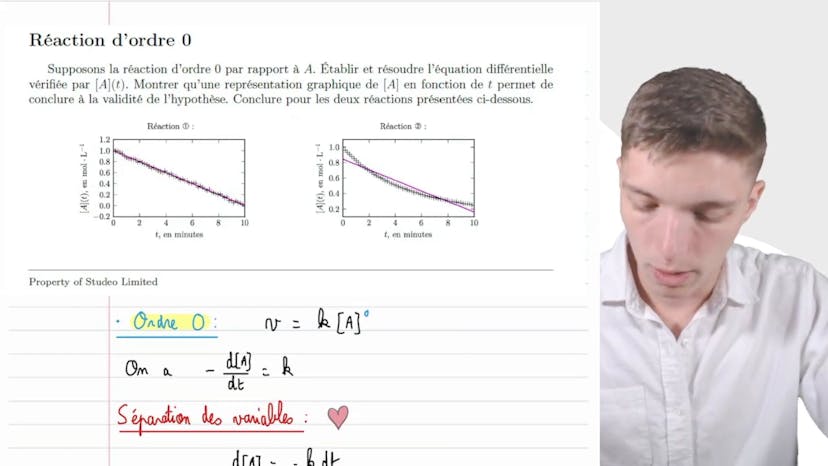
Pour les réactions d'ordre 0, la vitesse de réaction peut être exprimée comme V = k * [A]^0, où [A]^0 représente la concentration d'une espèce qui disparaît. En résolvant cette équation, on obtient que la concentration en fonction du temps est donnée par c = c0 - kt, où c0 est la concentration initiale et k est la constante de vitesse. Le temps de demi-réaction peut alors être calculé en résolvant c = c0/2, ce qui donne t1/2 = c0/(2k).
Pour les réactions d'ordre 1, la vitesse de réaction peut être exprimée comme V = k * [A]^1, où [A]^1 représente la concentration d'une espèce qui disparaît avec un coefficient stoichiométrique de 1. En suivant les étapes similaires, on obtient que la concentration en fonction du temps est donnée par c = c0 * e^(-kt). Le temps de demi-réaction peut alors être calculé en résolvant c = c0/2, ce qui donne t1/2 = ln(2)/k.
Enfin, pour les réactions d'ordre 2, la vitesse de réaction peut être exprimée comme V = k * [A]^2, où [A]^2 représente la concentration d'une espèce qui disparaît avec un coefficient stoichiométrique de 2. En suivant les étapes similaires, on obtient que la concentration en fonction du temps est donnée par c = c0/(1 + c0kt). Le temps de demi-réaction peut alors être calculé en résolvant c = c0/2, ce qui donne t1/2 = 1/(c0k).
En résumé, cette vidéo explique comment déterminer les temps de demi-réaction pour les réactions d'ordre 0, 1 et 2, en utilisant les équations d'évolution de la concentration en fonction du temps.