Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
La vitamine C sans sucre (3)
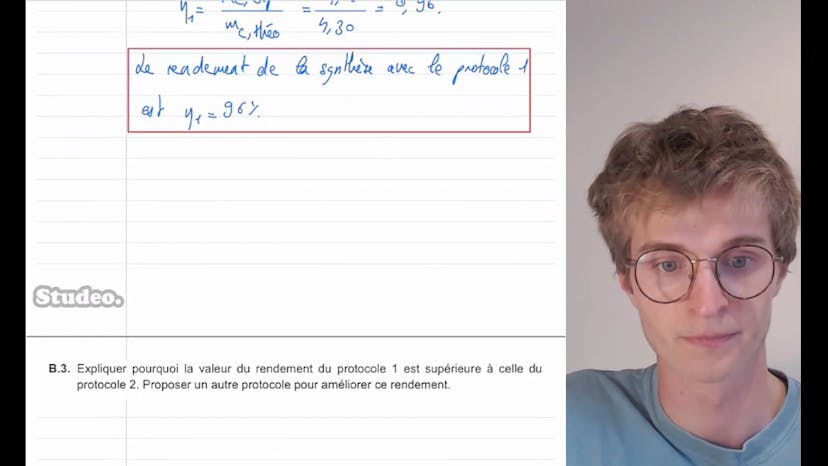
Dans cette vidéo, Théobald de Cidéo aborde le sujet de l'acide ascorbique, qui est le nom scientifique de la vitamine C. Il explique comment dissoudre cet acide dans l'eau et présente un exercice qui concerne le BAC de 2022 en Amérique du Nord. L'exercice consiste à calculer la concentration en quantité de matière de l'acide ascorbique lorsqu'un comprimé de 0,50 g est dissout dans 200,0 ml d'eau. Pour cela, Théobald utilise la formule de concentration en quantité de matière qui est le nombre de moles divisé par le volume de la solution. Il montre ensuite comment calculer cette concentration en utilisant la masse d'acide ascorbique, la masse molaire de l'acide ascorbique et le volume de la solution. Il obtient une concentration de 1,4 fois 10 moins 2 moles par litre, ce qui correspond à la réponse B de l'exercice. Ensuite, Théobald explique que l'acide ascorbique est un acide faible et que sa réaction avec l'eau est une réaction acido-basique. Il présente les couples d'espèces en présence et montre que la réaction se fait entre l'acide ascorbique et l'eau pour former les ions ascorbate et H3O+. Il mentionne également que le pH à l'équilibre de la solution est de 2,9. Théobald montre ensuite comment montrer que la constante d'acidité Ka peut s'écrire sous la forme donnée dans l'énoncé de l'exercice en utilisant les concentrations en ions H3O+ et ascorbate à l'équilibre et la concentration en quantité de matière apportée d'acide ascorbique. Il utilise un tableau d'avancement pour caractériser l'équilibre et montre que les concentrations en ions H3O+ et ascorbate à l'équilibre sont égales. En utilisant ces valeurs, il détermine la constante d'équilibre Ka. Il utilise ensuite Ka pour calculer le pKa du couple acide-ascorbique-ion-ascorbate, qui est de 3,9. Enfin, Théobald demande de représenter le diagramme de prédominance du couple ascorbique-ion-ascorbate en fonction du pH et de déduire la forme majoritaire dans l'estomac, où le pH est d'environ 2. Il explique que l'acide prédomine à pH faible et la base à pH élevé, et montre que dans l'estomac, qui a un pH de 2, la forme majoritaire est l'acide ascorbique. Théobald conclut en encourageant les spectateurs à poser des questions en commentaire et leur souhaite bonne chance pour leurs révisions.