Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Composition et évolution d'un système
- Prévision et stratégie en chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Composition et évolution d'un système
- Prévision et stratégie en chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Titrage d'un détartrant pour cafetière
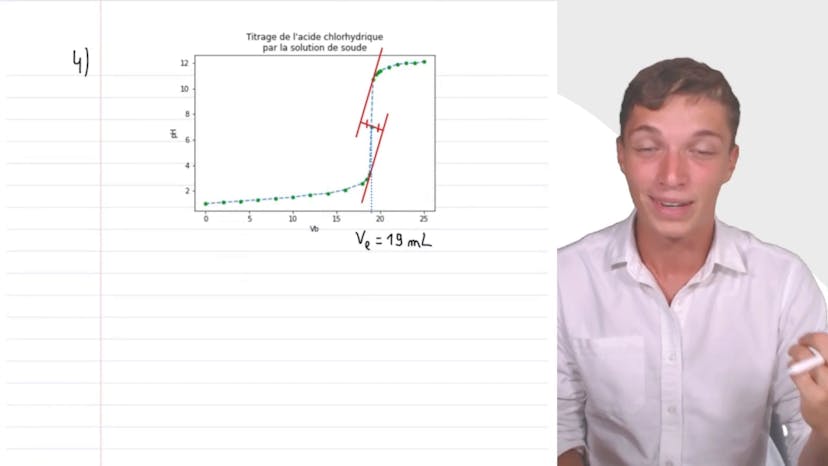
Dans cette vidéo, on nous présente l'acide sulfamique, un détartrant utilisé pour les cafetières. On prépare une solution en versant 1 g d'acide sulfamique dans une fiole jaugée de 100 ml et en complétant avec de l'eau distillée. On dose ensuite 20 ml de cette solution avec de la soude de concentration 0,1 mol/l. On trace ensuite la courbe pH-volume de la soude versée pour déterminer la pureté de la poudre contenue dans le sachet de détartrant. Pour cela, on pose des grandeurs arbitraires : MA (masse d'acide sulfamique dans le sachet) et CA (concentration d'acide sulfamique dans la solution). On utilise la réaction acide-base entre l'acide sulfamique et l'ion hydroxyle pour déterminer CA en utilisant la quantité de matière de l'acide A égale à la quantité de matière de HO-. On fait attention au volume que l'on titre (20 ml) et on utilise la méthode des tangentes pour déterminer VE (volume équivalent). On en déduit que CA est égal à 0,103 mol/l. En utilisant cette relation, on peut isoler MA (masse d'acide sulfamique) et on obtient 1 g, ce qui nous permet de conclure que le sachet est bien pur.