Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Le sel d’oseille (2)
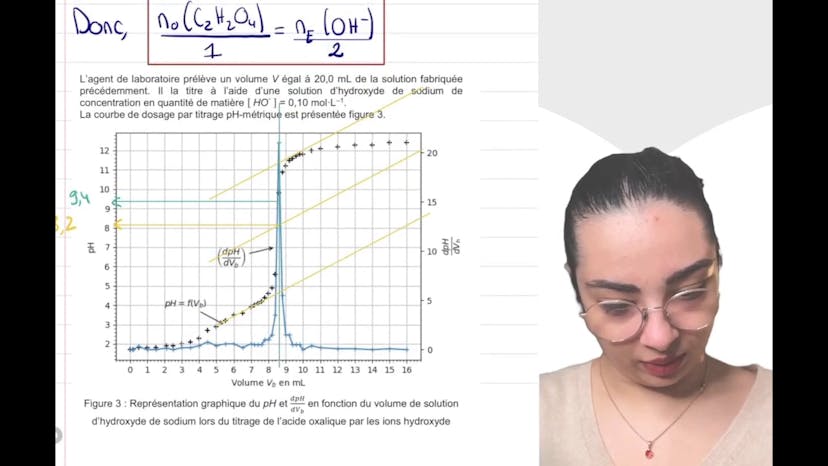
Le sujet de ce cours porte sur les diacides, en particulier sur l'acide oxalique. Dans une vidéo précédente, on a émis l'hypothèse que l'acide oxalique était un diacide fort, mais cette hypothèse a été invalidée par des expériences détaillées dans la vidéo précédente. Une deuxième hypothèse est donc formulée : l'acide oxalique est considéré comme un monoacide faible en solution. On étudie les concentrations en acide apporté, le pKa (première acidité de l'acide oxalique) et la réaction associée. On rappelle également que le pH de la solution est de 1,47. On demande ensuite d'écrire l'équation modélisée de la transformation de l'espèce AH- avec de l'eau. En utilisant la figure 1, on détermine ensuite le pKa de la deuxième acidité de l'acide oxalique, qui est d'environ 4,3. On utilise ensuite la courbe de distribution théorique pour donner le pourcentage approximatif de chaque espèce présente dans la solution. On constate que seule la forme AH2 et AH- sont présentes, tandis que la forme A2- est négligeable. On peut donc considérer que l'acide oxalique se comporte comme un monoacide faible. On passe ensuite à l'aspect théorique en exprimant la constante d'acidité K1 en fonction des concentrations des espèces à l'équilibre. On introduit également l'équation du second degré et on utilise un code Python pour calculer la concentration en oxonium (H3O+). Ce code Python résout l'équation du second degré et donne un pH final très proche de la valeur expérimentale. On conclut en validant l'hypothèse que l'acide oxalique se comporte comme un monoacide faible. Dans la prochaine vidéo, on abordera la partie 3 de cet exercice.