Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
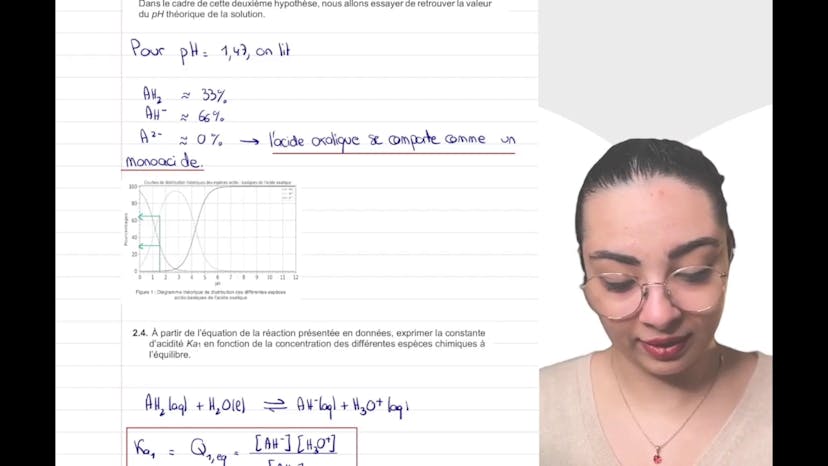
Le sel d’oseille (3)
Le cours porte sur l'acide oxalique et ses différentes formes (pure et hydratée). Le problème à résoudre est de déterminer si un solide blanc trouvé dans un récipient contient de l'acide oxalique hydraté ou pur. Pour cela, un titrage par suivi pH métrique est effectué sur une solution aqueuse.
Dans un premier temps, la concentration massique de la solution est calculée en prenant en compte les conditions expérimentales et leur incertitude. L'équation support du titrage est donnée pour trouver cette concentration.
La justifications du coefficient 2 devant l'ion hydroxyde de l'équation de la réaction est expliquée en considérant que l'acide oxalique est un diacide qui nécessite deux ions H+ pour réagir.
Afin d'utiliser un dosage par titrage direct, il est nécessaire que la transformation chimique soit unique, totale et rapide. D'autres méthodes expérimentales peuvent également être utilisées pour déterminer les concentrations.
La relation entre les quantités de matière en espèce titrée et titrante à l'équivalence est donnée par la proportion stoichiométrique des réactifs.
Pour déterminer le pH à l'équivalence, deux méthodes sont présentées. La première consiste à observer le pic de la dérivée de la courbe de pH en fonction du volume. La seconde utilise la méthode des tangentes pour trouver le pH au point médian entre les deux tangentes tracées. Selon ces méthodes, les valeurs de pH à l'équivalence sont respectivement de 9,2 et 8,2.
En choisissant un indicateur coloré, il est préférable de prendre en compte les deux sauts de pH observés. La phénolphthaleine est recommandée car elle couvre les deux domaines de changement de couleur.
Finalement, en utilisant les résultats du titrage, la concentration en quantité de matière d'acide oxalique est déterminée, puis on peut conclure si l'acide est hydraté ou non. En comparant la concentration massique obtenue avec les valeurs fournies au début de l'exercice, on peut conclure que l'acide oxalique est hydraté.
Il est recommandé d'exploiter les résultats du titrage et de considérer les concentrations massiques pour répondre aux questions sur l'hydratation de l'acide oxalique.