Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- BAC 2021
- BAC 2022
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
La vitamine C sans sucre (3)
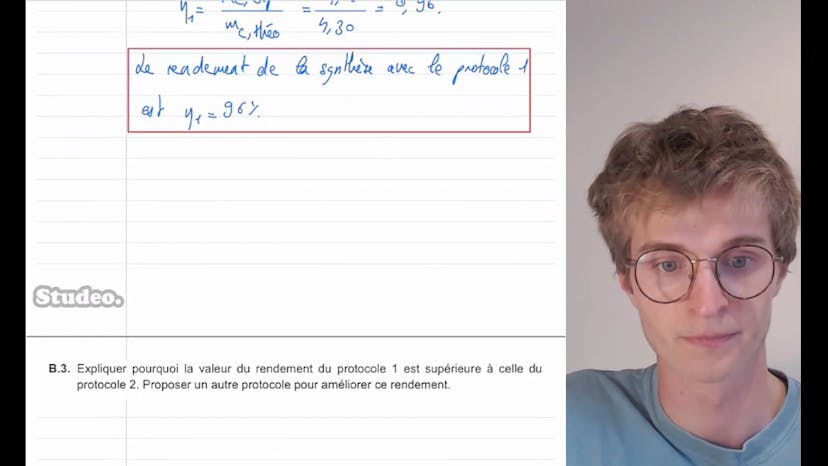
Dans cette vidéo, Théobald de Cidéo explique l'acide ascorbique, qui est le nom scientifique de la vitamine C. Il aborde un exercice du BAC portant sur l'acide ascorbique. Dans cet exercice, il est demandé de calculer la concentration en quantité de matière de l'acide ascorbique dans une solution obtenue en dissolvant un comprimé de 0,50 g d'acide ascorbique dans 200,0 ml d'eau. Théobald utilise la formule de concentration en quantité de matière qui est le nombre de moles divisé par le volume de la solution. Il calcule ensuite la concentration en quantité de matière de l'acide ascorbique, qui est de 1,4 x 10^-2 mol/L, correspondant à la réponse B.
Ensuite, Théobald explique comment écrire l'équation de réaction entre l'acide ascorbique et l'eau, en soulignant que l'acide ascorbique est un acide faible. Il présente les couples d'espèces présentes dans la réaction, et montre que la réaction se produit entre l'acide ascorbique et l'eau pour former l'ion ascorbate et l'ion H3O+. Il mentionne également que le pH à l'équilibre de la solution est de 2,9.
Théobald aborde ensuite le calcul de la constante d'acidité Ka, en montrant comment caractériser l'équilibre à l'aide d'un tableau d'avancement. Il utilise les concentrations en ion aspartame et en ion H3O+ pour déterminer la valeur de Ka, qui peut s'écrire selon la formule donnée dans l'énoncé.
L'étape suivante consiste à trouver la valeur de Ka et le pKa du couple acide ascorbique-ion ascorbate. Théobald substitue la concentration en ion H3O+ par C standard multipliée par 10^-pH dans la formule de Ka, et obtient une valeur de Ka égale à 1,2 x 10^-4. Il calcule ensuite le pKa, qui est égal à 3,9.
Enfin, Théobald représente le diagramme de prédominance du couple ascorbique-ion ascorbate en fonction du pH. Il indique que la forme majoritaire dans l'estomac, où le pH est d'environ 2, est l'acide ascorbique, car l'acide prédomine à pH faible. Il conclut la vidéo en souhaitant bonne chance dans les révisions et en proposant de poser des questions en commentaire.