All subjects
All subjects
 All subjects
All subjects
Configuration électronique
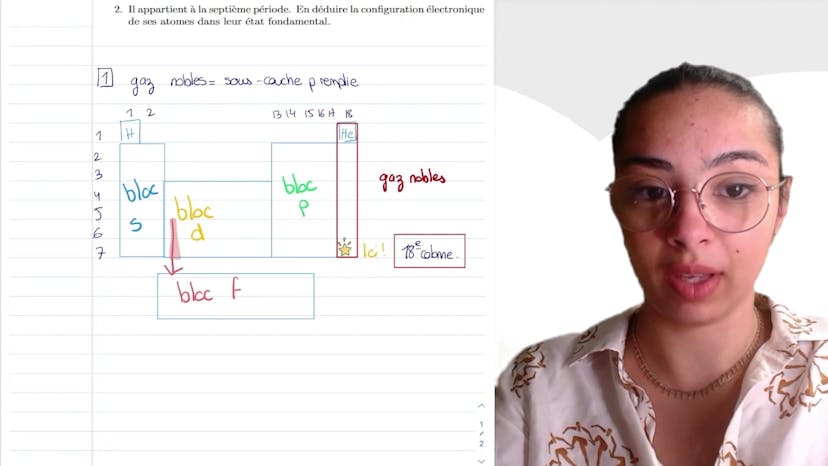
Salut à tous ! Aujourd'hui, nous allons travailler sur la classification périodique. L'exercice consiste à trouver la configuration électronique du brome et de son ion correspondant, en utilisant les configurations électroniques des gaz rares argon et krypton.
Pour rappel, il y a quelques règles à suivre lorsqu'on parle de configuration électronique. La règle de Shlekovski indique que les atomes sont classés par énergie croissante et par ordre croissant du nombre quantique N + L. Ensuite, nous avons le principe de Pauli qui stipule que deux électrons ne peuvent pas être décrits par les mêmes nombres quantiques.
Pour le brome (Br), nous commençons par remplir les couches dans l'ordre croissant. Nous avons la 1S, puis la 2S, la 3P, la 3S, la 3P, la 4S, la 3D, et enfin la 4P. La configuration se termine avec 4P5. En utilisant les configurations électroniques des gaz rares, nous pouvons écrire la configuration condensée du brome comme suit : [Kr] 5s² 4d¹⁰ 4p⁵.
Ensuite, nous passons à l'ion du brome (Br-). Nous devons réorganiser la configuration électronique en ordre croissant de n pour savoir quel électron doit être retiré. Ainsi, nous plaçons la sous-couche 3D10 avant la 4S2 et la 4P5. L'ion Br- est donc représenté par la configuration électronique [Kr] 5s² 4d¹⁰ 4p⁶, ce qui est la même configuration que le krypton (Kr).
En ce qui concerne les électrons de cœur et de valence de l'atome de Br- et du Br, les électrons de cœur sont ceux qui se trouvent dans les couches déjà remplies, tandis que les électrons de valence sont ceux dans les sous-couches en cours de remplissage. Pour l'ion Br-, les électrons de cœur comprennent la configuration de l'argon (3d¹⁰), tandis que les électrons de valence sont 4s² 4p⁶.
J'espère que ce résumé vous a été utile. N'hésitez pas à poser vos questions en commentaire. À bientôt !