All subjects
All subjects
 All subjects
All subjects
Composés hydrogénés
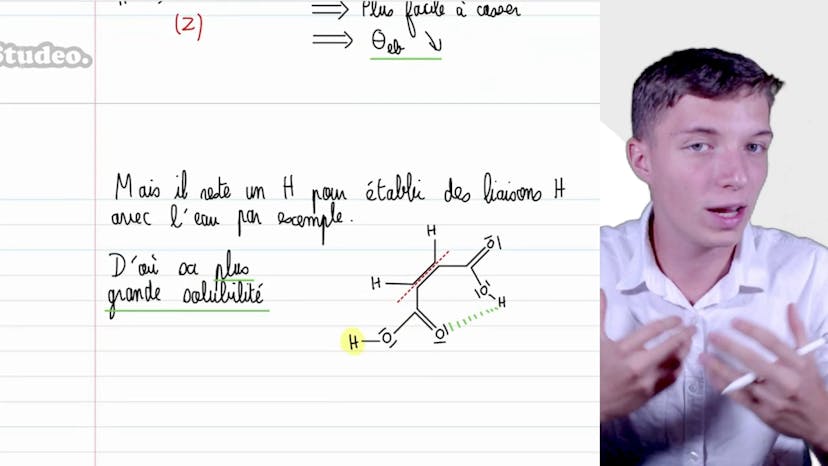
Dans cette vidéo, nous examinons l'évolution des températures d'ébullition des composés hydrogénés des éléments des colonnes 14 et 17 de la classification périodique. Le tableau 6 présente ces températures d'ébullition sous une pression atmosphérique standard. En utilisant la représentation graphique de la molécule de méthane, nous pouvons déduire que cette molécule est apolaire. Les autres composés hydrogénés de la colonne ont également une géométrie tétraédrique et sont apolaires. La raison pour laquelle les composés hydrogénés des éléments de la colonne 14 ont des températures d'ébullition plus basses que ceux de la colonne 17 est due aux interactions moléculaires. Les composés hydrogénés des éléments de la colonne 17 sont polaires et ont des interactions de type quissomme, ce qui rend leur température d'ébullition plus élevée. Les interactions de London prédominent dans les molécules de taille plus importante, comme HBr et HI, ce qui explique l'augmentation continue des températures d'ébullition. Une anomalie est observée pour HF, où la température d'ébullition est plus élevée que prévu. Cela est dû à la nature très électronégative de l'atome de fluor, qui entraîne des liaisons hydrogènes plus fortes entre les molécules de HF. Ainsi, il faut plus d'énergie pour séparer ces molécules, ce qui conduit à une température d'ébullition élevée. Cette transcription fournissait une analyse des interactions moléculaires et de leurs effets sur les températures d'ébullition des composés hydrogénés.