 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Physique
Terminale

Eloignement d'une galaxie
Dans cette vidéo, on apprend comment utiliser l'effet Doppler pour déterminer la vitesse d'éloignement d'une galaxie en astrophysique. Pour cela, on mesure le décalage de la longueur d'onde de l'hydrogène observé sur Terre par rapport à celui observé dans la galaxie. On utilise ensuite la formule V = delta lambda C / lambda E pour isoler la vitesse d'éloignement, qui est de 1,2 x 10^7 m/s dans ce cas. On peut ensuite utiliser la constante de Hubble et la distance en années-lumières pour calculer la distance entre la galaxie et la Terre, soit 5,2 x 10^8 années-lumière. La vidéo explique également que la lumière qu'on observe d'une galaxie est ce qui s'est passé il y a de nombreuses années, donnant ainsi un aperçu du passé en astrophysique.
Physique-Chimie
Physique
Terminale

Bruit sur un chantier
Dans cette vidéo, on évalue le bruit d'un chantier pour savoir si cela peut causer des dommages auditifs à un ouvrier. On utilise l'expression de la dilution sphérique pour déterminer la puissance sonore émise par l'engin à différentes distances. On utilise aussi une formule pour calculer le niveau d'intensité sonore en décibels. Le seuil de danger pour le système auditif est de 85 dB. On montre l'importance de porter des casques anti-bruit, qui ont une atténuation d'au moins 20 dB, afin de protéger l'ouïe. En se déplaçant à 10 mètres, ou en portant un casque anti-bruit à un mètre, l'ouvrier est protégé et le niveau d'intensité sonore est en dessous du seuil de danger.
Physique-Chimie
Physique
Terminale

Voiture et effet Doppler
Aujourd'hui, dans cet exercice sur l'effet Doppler, nous étudions ce qui se passe lorsque qu'une voiture s'approche d'un piéton. La voiture se déplace le long de l'axe OX à une vitesse constante V et émet un son de fréquence FE. Le piéton se situe à une distance D de l'axe.
Tout d'abord, nous devons déterminer cosθ en fonction de X et D. En utilisant les formules trigonométriques, nous savons que cosθ est le côté adjacent sur l'hypoténuse. Ici, le côté adjacent est X et l'hypoténuse est √(D² + X²). Donc, nous avons cosθ = X/ √(D² + X²).
Ensuite, nous pouvons utiliser cette formule pour calculer la fréquence reçue (FR) en fonction de X. La formule est FR = FE * (1 + (V * cosθ) / (V du son) * √(D² + X²). Cette transformation de cosθ en X est utile car X est le seul paramètre dont nous disposons.
Ensuite, nous examinons quatre graphiques et devons déterminer lequel représente l'évolution de la fréquence en fonction de X. Pour cela, nous pouvons utiliser l'élimination. Nous savons que FR est une fonction décroissante, car plus X augmente, plus la fréquence diminue. De plus, lorsque X = 0, FR doit être égal à FE, car le piéton est directement en face de la voiture. Parmi les graphiques proposés, seul celui de la figure 1 satisfait ces critères.
Ensuite, nous analysons comment la courbe évolue si V ou D augmentent. Si V augmente, FR augmente également car V est dans le numérateur de la formule. De même, si FE augmente, FR augmente aussi car FE est un facteur de la formule. En revanche, si D augmente, FR diminue car D est situé dans le dénominateur de la formule.
En résumé, lorsque la voiture s'approche du piéton, la fréquence reçue diminue. La figure 1 représente l'évolution de la fréquence en fonction de la distance X. Si la vitesse de la voiture ou la distance entre la voiture et le piéton augmentent, la fréquence reçue augmente. N'hésitez pas à poser vos questions en commentaire.
Physique-Chimie
Physique
Terminale
Casque à réduction de bruit
Dans ce cours, Layla de CEDEO explique le concept de réduction de bruit active sur les casques audio. Lorsqu'on active la réduction de bruit sur nos casques, un signal anti-bruit est émis pour combiner avec le bruit ambiant, ce qui crée l'impression d'absence de bruit.
Le cours présente plusieurs configurations de casques : sans casque, avec une réduction de bruit passive (casque isolant) et avec une réduction de bruit active. Un graphique montre comment ces différentes configurations affectent le niveau d'intensité sonore en fonction de la fréquence.
Il est expliqué que le casque passif n'est efficace que pour certaines fréquences graves, tandis que la réduction de bruit active est plus efficace dans une zone spécifique (zone B). Dans une autre zone de transition, les deux types de réduction de bruit sont efficaces, mais avec des degrés d'efficacité variables en fonction de la fréquence. Dans la dernière zone, les deux types de réduction de bruit sont également efficaces.
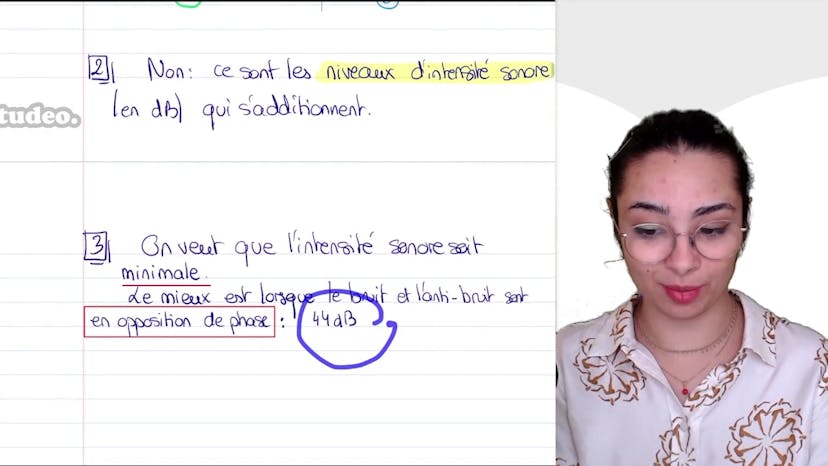
Ensuite, le cours aborde la question de l'émission simultanée de bruit et d'anti-bruit dans différentes situations. On explique que ce sont les niveaux d'intensité sonore qui s'additionnent, pas les intensités sonores elles-mêmes. Les niveaux d'intensité sonore sont mesurés en décibels.
Enfin, on demande quelle situation est la plus efficace pour le dispositif de réduction active de bruit. La réponse est lorsque le bruit et l'anti-bruit sont en opposition de phase, ce qui entraîne la plus grande atténuation du niveau sonore.
Physique-Chimie
Physique
Terminale

Vélocimétrie Doppler
La vélocimétrie Doppler est une méthode non-invasive pour mesurer la vitesse du sang, souvent utilisée en médecine pour détecter des problèmes vasculaires. On utilise une sonde émettant des ultrasons à une certaine fréquence, les globules rouges affectent ensuite cette onde avec une fréquence différente à cause de l'effet Doppler. On peut déterminer la vitesse des globules rouges en analysant un spectre et en isolant les fréquences correspondant à la fréquence émise et reçue. On applique ensuite une formule pour trouver la vitesse des ultrasons qui nous donne une vitesse d'environ 42 cm par seconde, correspondant à l'ordre de grandeur de la vitesse du sang dans le corps humain.
Physique-Chimie
Physique
Terminale

Musiciens dans un train
Dans cette vidéo, Christophe Buballot a mené une expérience pour vérifier l'effet Doppler en plaçant des musiciens dans un train qui jouaient une note (La 440) et en faisant écouter cette note à des auditeurs le long de la voie. Les auditeurs ont perçu une fréquence différente de la note émise en raison du mouvement de l'onde sonore par rapport à eux. La fréquence reçue dépendait de la note jouée par les musiciens, qui était exprimée en Hertz. En utilisant la formule de l'effet Doppler, la vitesse du train a été calculée à partir de l'écart entre la fréquence émise et la fréquence reçue des notes. La vitesse calculée était de 63,4 km/h, ce qui est raisonnable pour un train de l'époque.
Physique-Chimie
Chimie
Terminale

L'acide palmitique
Dans cette vidéo, l'expert Matisse de Studio parle de l'huile de palme et explique pourquoi sa molécule est considérée comme un acide carboxylique en raison du groupe COOH qu'elle contient. Il explique également quel atome d'hydrogène est responsable de son caractère acide et comment représenter la base conjuguée de cet acide. La vidéo se termine par une invitation à s'entraîner davantage sur ce sujet.
Physique-Chimie
Chimie
Terminale

pH et dilution
Dans cette vidéo, Matisse de Studio nous explique comment calculer le pH et la dilution d'une solution d'acide sulfurique de concentration 8,0 10-2 mol par litre, que nous avons besoin de diluer cinq fois pour préparer 200 millilitres d'acide dilué. Pour calculer le pH, il faut connaitre la formule standard pH = -log[H3O+]. En utilisant le tableau d'avancement, nous avons déterminé que la concentration de l'H3O+ dans la solution mère était 2C0, alors le pH est 0,8. En utilisant la formule du facteur de dilution, nous avons déterminé la concentration de l'H3O+ dans la solution fille, qui est C0/5, puisque nous avons dilué la solution cinq fois. Le pH de la solution fille est -log(C0/5), qui est 1,5, moins acide que la solution mère.
Physique-Chimie
Chimie
Terminale

Eau minérale
Dans cette vidéo, une étude d'une eau minérale est entreprise en effectuant différentes mesures de concentration comme le pH qui est de 7,4 plus ou moins 0,2 et contient 468 mg par litre d'ion calcium. Il est déterminé que l'incertitude sur le pH est de 0,2 unité près, et cela ne pose pas de problème car c'est l'ordre de grandeur des incertitudes des relevés expérimentaux de mesure du pH. La concentration en Nuon Oxonium est obtenue en reliant le pH qui est entre 7,2 et 7,6, grâce à la formule qui montre que la concentration en H3O plus 7 égale à 10 puissance moins pH. Cette concentration en H3O plus est ensuite convertie en concentration massique en utilisant la relation entre la concentration massique et la concentration molaire. La concentration massique en H3O plus est calculée pour être entre 4,8 10,7 et 1,2 10,6 g par litre. Enfin, la concentration en ion oxonium est comparée à celle en ion calcium, et il est déterminé qu'il y a environ 300 000 fois plus d'ion calcium que d'ion oxonium dans cette bouteille.
Physique-Chimie
Chimie
Terminale
Analyse de la pyridine
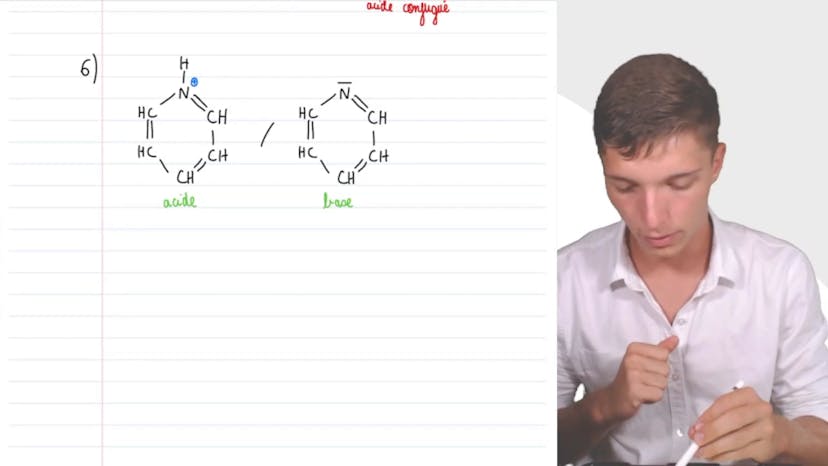
Dans cette vidéo, on étudie la molécule de pyridine, utilisée en pharmacie et dans la fabrication d'insecticides. On donne le schéma de Lewis de cette molécule, qui se caractérise par un cycle à 5 atomes de carbone et 1 atome d'azote, ainsi que par son doublet non-liant. On détermine ensuite que la pyridine n'a pas de caractère acide, car aucun de ses hydrogènes ne peut être cédé. En revanche, elle a un caractère basique, car son doublet non-liant peut capter un proton H+. L'acide conjugué de la pyridine est représenté par une mini-réaction dans laquelle l'atome d'azote a perdu une charge positive, tandis que l'hydrogène est devenu neutre. Enfin, le couple acide-base de la pyridine est donné. Il est important de connaître les caractères acides et basiques des molécules pour savoir si elles peuvent interagir avec d'autres.
Physique-Chimie
Chimie
Terminale

Repérage d'acidité
Dans cette vidéo, Mathis de Studio explique l'acidité d'une molécule, en l'occurrence le 4-tert-butyl-pyro-catécole utilisé comme inhibiteur de polymérisation dans les plastiques. Il explique que selon la définition de Brosted, un acide est une molécule capable de céder un proton H+. Dans cette molécule, il y a deux hydrogènes reliés à des atomes d'oxygène qui peuvent être cédés, ce qui confère à la molécule des propriétés acides. Pour illustrer les couples acides-bases possibles, Mathis fait apparaître les bases conjuguées associées à l'acide en cédant successivement un ou deux protons. Il mentionne également que bien que cette molécule ait des caractères acides, elle n'est pas un acide carboxylique car elle ne contient pas le groupement carboxyles COOH.
Physique-Chimie
Chimie
Terminale

Beurre acide
L'acide butyrique est un acide carboxylique dérivé du butane, avec une chaîne carbonée linéaire de 4 carbones. Son nom vient du latin butyrum, signifiant beurre, en raison de son odeur caractéristique. La formule semi-développée de l'acide butyrique est H3C, CH2, CH2, COH. Le schéma de Lewis montre la double liaison oxygène avec les deux doublets non-liants, et l'oxygène avec ses deux doublets non-liants relié au carbone et à l'hydrogène. On explique que le caractère acide est déterminé par l'hydrogène relié à l'atome d'oxygène. Ensuite, on présente le butanoate de méthyl, un estère utilisé comme arôme pour son odeur de pomme, obtenu à partir de l'acide butyrique. Sa formule est CH3CH2 2 COOCH3. On explique que cet estère n'a pas de caractère acide, car on a remplacé l'hydrogène capable d'acidité par un groupement CH3. Le cours se termine en remerciant les spectateurs de leur attention.


