Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Van der Waals
Dans cette vidéo, on découvre que l'équation d'état des gaz parfaits, notre équation préférée dans ce chapitre, est en fait un cas particulier d'une équation plus générale, l'équation de Van der Waals. Cette équation relie la pression, le volume et la température d'un fluide à l'aide de deux constantes positives, A et B, qui caractérisent le fluide. Pour une mole de gaz, l'équation devient P + A/V^2(V-B) = RT.
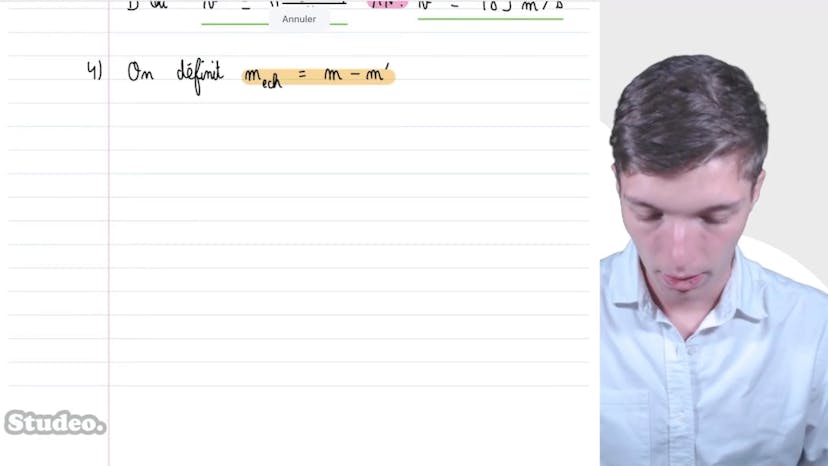
Il est possible de généraliser cette équation de Van der Waals pour N moles de fluide en prenant en compte le comportement des variables (pression, volume et température) lors du passage d'un système d'une mole à un système de N moles. La pression est une variable intensive, ce qui signifie qu'elle conserve sa valeur lorsqu'on combine deux sous-systèmes indépendants. La température est également une variable intensive. En revanche, le volume est une variable extensive, ce qui signifie qu'il augmente proportionnellement au nombre de moles de gaz.
En remplaçant V par V' = nV, où n est le nombre de moles de gaz, dans l'équation de Van der Waals, on obtient une version de l'équation pour un système constitué de N moles. En multipliant l'équation initiale par n, on retrouve V' dans l'équation.
En posant A = 0, on étudie l'influence de B, appelé covolume, qui représente l'effet de répulsion à courte distance entre les molécules. Pour l'hydrogène, on donne une estimation approximative de B en se basant sur la distance de liaison entre deux atomes d'hydrogène.
En posant B = 0, on étudie l'influence de A, qui représente l'effet attractif à courte distance entre les atomes. A a un effet opposé à B, avec un signe positif.
Le terme correctif de la pression dans l'équation de Van der Waals est une fonction décroissante du volume. Cela s'explique par le fait que plus le volume est important, moins l'effet attractif entre les atomes est intense. L'effet attractif perd en intensité lorsque les atomes sont éloignés les uns des autres, ce qui est pénalisé en divisant par V².
En conclusion, cet exercice permet de manipuler et d'analyser l'équation de Van der Waals, en comprenant ses différentes constantes et leurs effets sur la pression, le volume et la température des fluides.