Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Halogènes
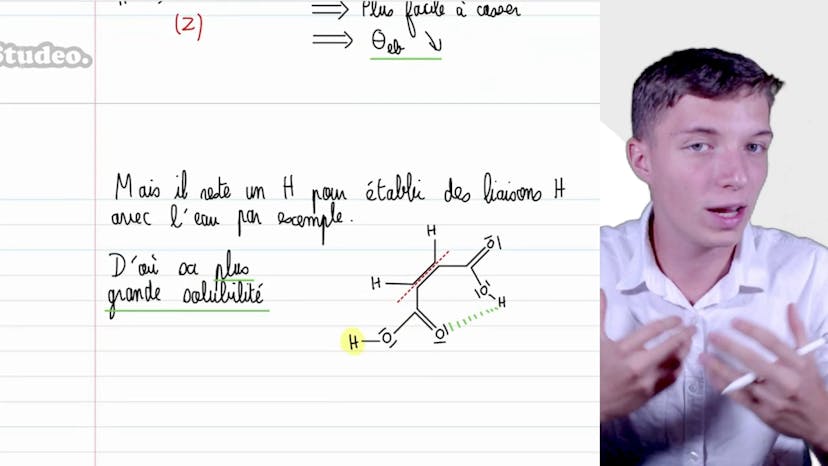
Dans cette vidéo, nous étudions les propriétés physiques des halogènes. Nous cherchons à corréler l'évolution des températures de changement d'état des dihalogènes aux rayons de Van der Waals des atomes correspondants. Les températures de fusion et d'ébullition dépendent des interactions entre les molécules. Dans le cas des halogènes, les interactions de type Van der Waals sont à l'œuvre, en particulier les interactions de type London. Ces interactions dépendent de la taille du nuage électronique. Plus le nuage électronique est gros, plus les interactions de London sont fortes et plus les températures de fusion et d'ébullition sont élevées.
Dans un autre exercice, nous étudions l'évolution des températures de fusion pour des espèces de formule Cx4. Les interactions en jeu sont toujours de type London. Lorsque le volume de polarisabilité des liaisons Cx augmente, les températures de fusion augmentent également.
Enfin, nous analysons l'évolution des températures de fusion pour des espèces chlorées. Les interactions entre molécules sont de type qui somme, dipôle permanent. En gardant des interactions de type London, la température de fusion augmente lorsque le volume de polarisabilité et la norme du moment dipolaire augmentent.
Cet exercice permet de comprendre et d'analyser les interactions moléculaires en fonction des observations expérimentales.