Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Moment dipolaire
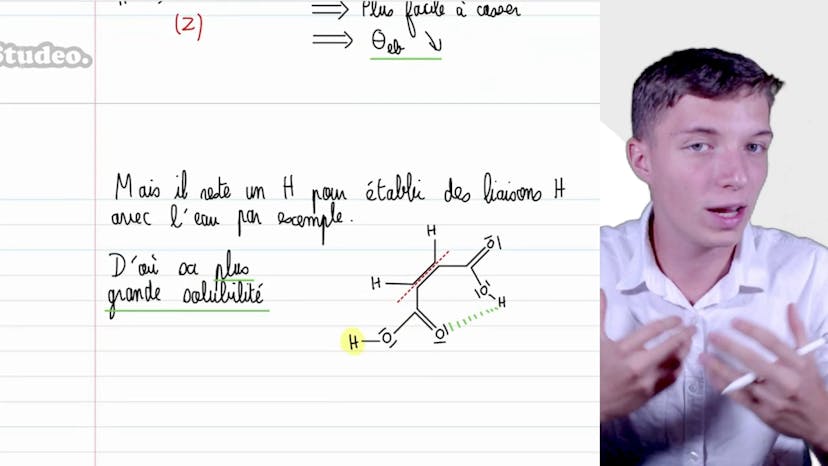
Dans cette vidéo, Matisse de Studio aborde le sujet de la représentation des moments dipolaires des molécules chimiques. Il explique comment déterminer la direction et le sens de ces moments pour différents édifices chimiques. Les molécules étudiées sont OCS, H2S, N2O+, CCL4, et NO2-. Matisse commence par expliquer comment la différence d'électronégativité entre les atomes impliqués influence la polarité de la liaison chimique. Pour OCS, il y a une différence d'électronégativité entre l'oxygène et le carbone, mais pas entre le soufre et le carbone. Par conséquent, il y a un seul moment dipolaire entre l'oxygène et le carbone. Pour H2S, la différence d'électronégativité entre l'hydrogène et le soufre est faible, mais il existe deux moments dipolaires en raison des différentes liaisons. Pour N2O+, il y a une différence suffisante d'électronégativité pour qu'il y ait un moment dipolaire, mais étant donné que la molécule est symétrique, les deux moments dipolaires se compensent et le moment dipolaire total est nul. Pour CCL4, qui a une forme de tétraèdre, les quatre moments dipolaires se compensent également, donnant un moment dipolaire total nul. Pour NO2-, une différence de longueur entre les liaisons simple et double impliquant l'azote et l'oxygène indique une différence de moment dipolaire, mais en raison de la mesomérie, les liaisons sont équivalentes et le moment dipolaire global est orienté verticalement. Enfin, pour NO2-, où deux atomes d'oxygène sont reliés de manière équivalente par mesomérie, le moment dipolaire global est faible mais légèrement orienté. Matisse souligne que la détermination des moments dipolaires est importante pour comprendre les propriétés physico-chimiques des molécules.