Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Interactions aquatiques
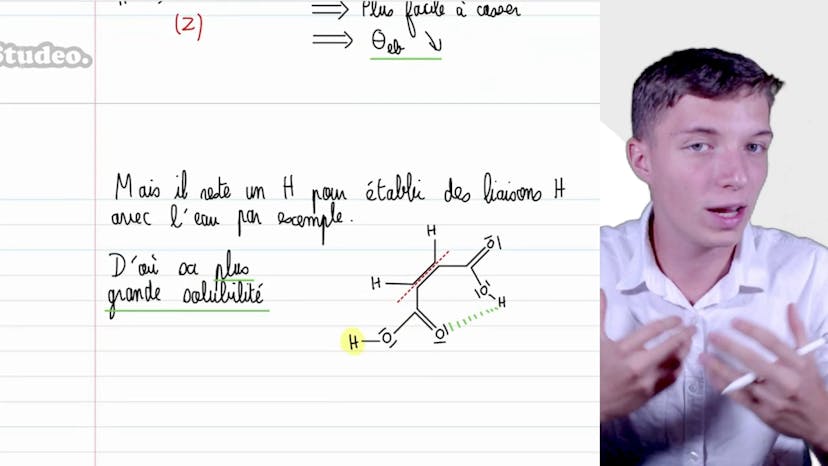
Dans cette vidéo, Matisse de Studio aborde les différences de propriétés en relation avec l'eau. Il commence par interpréter la solubilité à température ambiante de trois composés gazeux : le CO2, le SO2 et le NH3. Le CO2 a une solubilité assez faible car il est apolaire, contrairement à l'eau qui est polaire et protique. Le SO2, en revanche, a une solubilité plus importante car il établit des liaisons de quissomme avec l'eau. L'ammoniaque est très soluble dans l'eau car elle est polaire, protique et peut former des liaisons de quissomme ainsi que des liaisons hydrogènes avec l'eau.
Ensuite, Matisse analyse la différence de solubilité dans l'eau à température ambiante de trois liquides : l'éthanol, l'aniline et le benzène. L'éthanol est polaire et protique, ce qui explique sa grande miscibilité avec l'eau. L'aniline est faiblement polaire et protique, ce qui lui confère une faible interaction avec l'eau. Le benzène, en revanche, est apolaire et aprotique, d'où son absence totale de solubilité dans l'eau.
Il souligne l'importance de ces notions en chimie expérimentale lors de l'isolation ou de l'extraction de certains éléments actifs ou molécules. Il mentionne également que le cyclohexane est un solvant très particulier et intéressant à cet égard en raison de son caractère apolaire et aprotique.
En conclusion, Matisse rappelle l'importance de comprendre quelles interactions peuvent se produire entre les différents solvants et souligne que "qui se ressemble s'assemble".