Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Isomères de position
Dans cette vidéo, nous analysons la différence de température d'ébullition entre deux isomères de position, l'exam 2,4-diol et l'exam 2,6-diol. Les températures d'ébullition dépendent des interactions entre les molécules. Plus ces interactions sont fortes, plus il faut d'énergie pour les rompre, ce qui entraîne une température d'ébullition plus élevée.
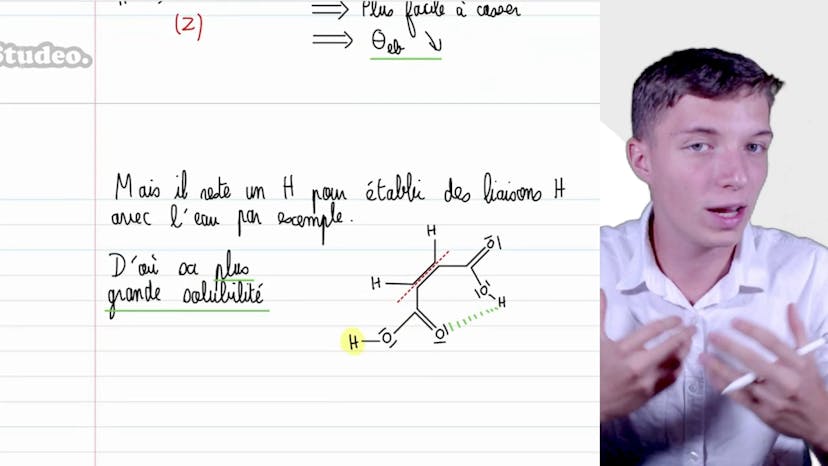
Les deux isomères diffèrent par la position de leurs groupements hydroxyle. Dans le premier isomère, les groupements hydroxyle sont rapprochés, formant une liaison hydrogène intramoléculaire qui renforce la cohésion de la molécule. Cependant, cela diminue les interactions entre les molécules.
Dans le deuxième isomère, il y a deux groupements hydroxyle, permettant des liaisons hydrogène avec d'autres molécules. Ainsi, la cohésion entre les molécules du solvant est renforcée et doit être rompue lors de l'ébullition. Ce raisonnement explique pourquoi l'isomère exam 2,6-diol a une température d'ébullition plus élevée que l'isomère exam 2,4-diol.
Il est important de comprendre ces différences entre les liaisons intramoléculaires et intermoléculaires pour appréhender les propriétés physiques des molécules. Cette analyse nous permet de comprendre pourquoi les isomères peuvent présenter des différences de température d'ébullition.