Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Réaction d'ordre 2
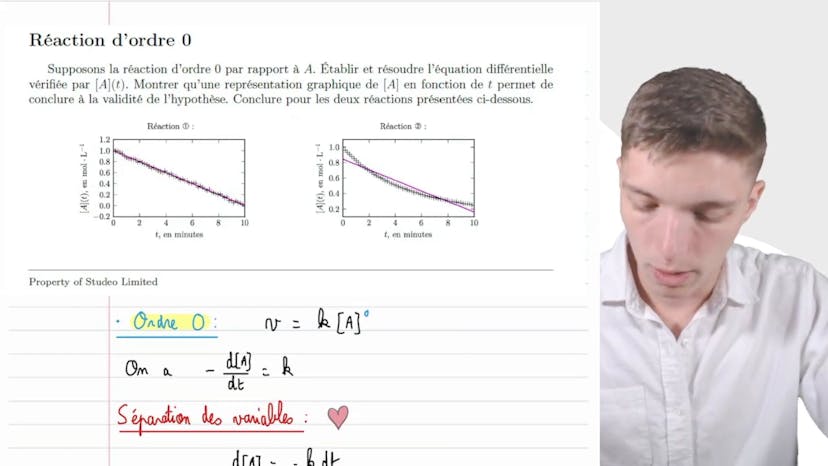
Dans cette vidéo, nous allons vérifier si une réaction est d'ordre 2 ou non. Pour cela, nous supposons que la réaction est d'ordre 2 par rapport au réactif A. Nous devons établir et résoudre l'équation différentielle vérifiée par la concentration de A en fonction du temps. Une représentation graphique de 1/concentration en fonction du temps nous permettra de conclure à la vérité de l'hypothèse pour les deux réactions présentées.
Pour la réaction 1, nous observons une droite qui peut être modélisée et qui passe par la plupart des points. Cela est cohérent. Pour l'autre réaction, nous avons un polynôme qui est mal approximé par la régression linéaire.
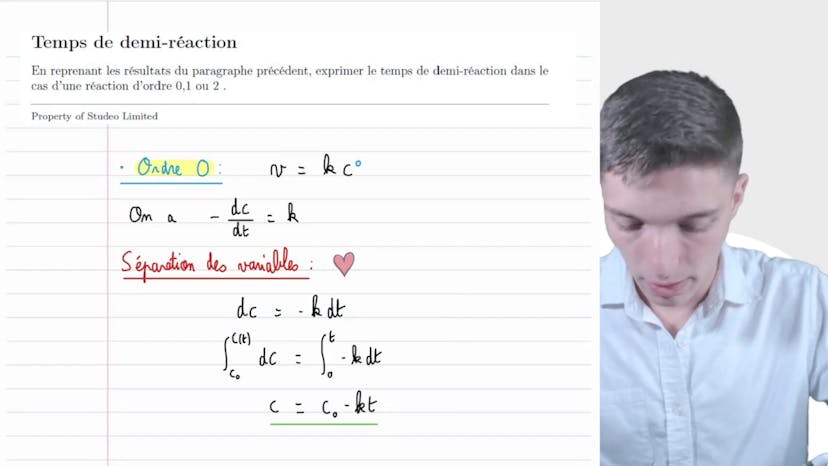
Pour exprimer 1/concentration en fonction du temps, nous utilisons l'équation v=k[A]^2. En effectuant la séparation des variables et en intégrant, nous obtenons la relation 1/concentration à l'instant t = kt + 1/concentration initiale.
Cette relation nous dit que la courbe de 1/concentration en fonction du temps est une fonction affine et croissante. Ainsi, la réaction 1 présente une cinétique d'ordre 2 par rapport à A. Ce n'est pas le cas pour la réaction 2.
En conclusion, en analysant l'évolution de la concentration en fonction du temps, nous pouvons déterminer l'ordre de la réaction. Cette démarche est puissante et nous permet de comprendre les caractéristiques cinétiques des réactions. Merci d'avoir visionné cette vidéo et à bientôt !