Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Décomposition de l'éthanal
Dans cette vidéo, nous étudions la décomposition de l'éthanal (CH3CHO) en méthane (CH4) et monoxyde de carbone (CO). Les composés sont tous gazeux. Nous sommes également dans une enceinte fermée et indéformable, avec une pression initiale P0.
Nous écrivons l'équation de la réaction et construisons le tableau d'avancement. On constate que la mesure de la pression à l'intérieur de l'enceinte permet de suivre l'avancement de la réaction, car elle dépend directement du nombre de moles des différents composés. On exprime la pression en fonction de l'avancement et des molécules présentes.
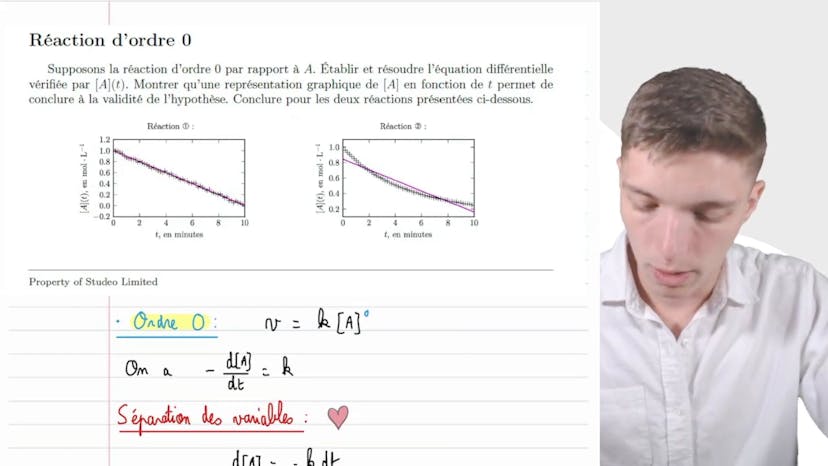
Ensuite, on montre expérimentalement que la fonction f est proportionnelle à la température T. On utilise la formule de la concentration en éthanal pour une réaction d'ordre 2 et exprimons f en fonction de cette formule. On démontre alors que f est une fonction linéaire du temps, ce qui est compatible avec une réaction d'ordre 2.
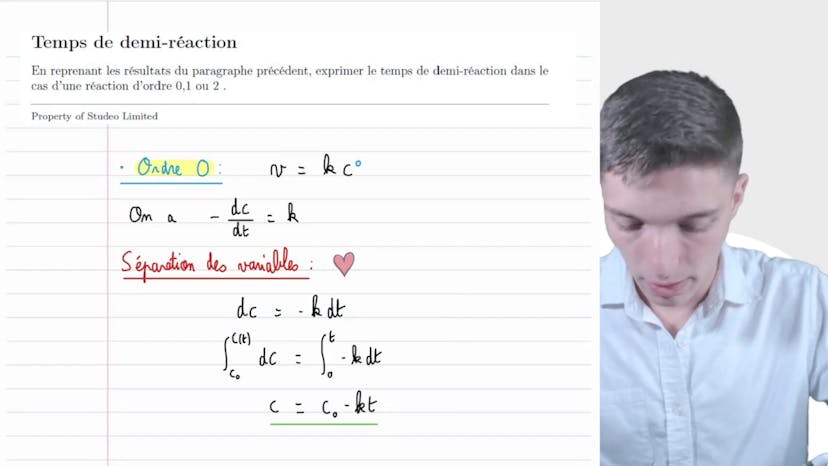
Nous calculons ensuite le temps de demi-réaction en utilisant les informations disponibles et obtenons l'expression V/(N0*K), typique d'une réaction d'ordre 2. Enfin, nous notons que si le volume est doublé, le temps de demi-réaction sera également deux fois plus important.
En conclusion, cet exercice nous montre l'importance d'exprimer les grandeurs en fonction des hypothèses et des formules disponibles. Il permet également de comprendre comment mesurer et suivre l'avancement d'une réaction grâce à une grandeur physique, comme la pression.