Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
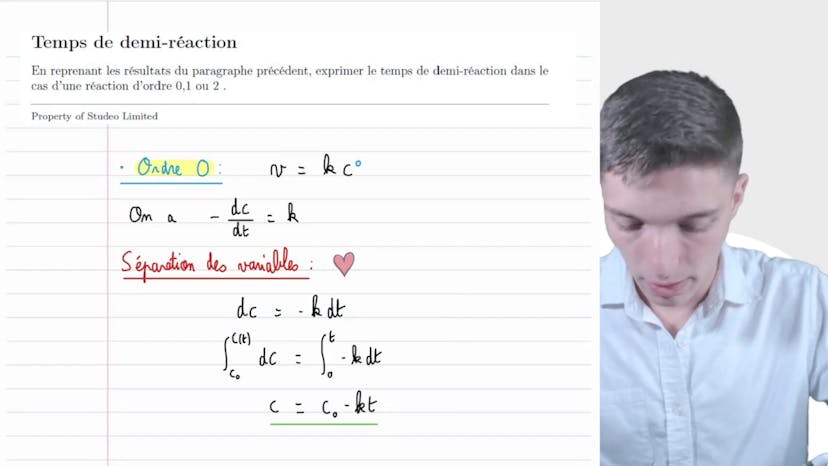
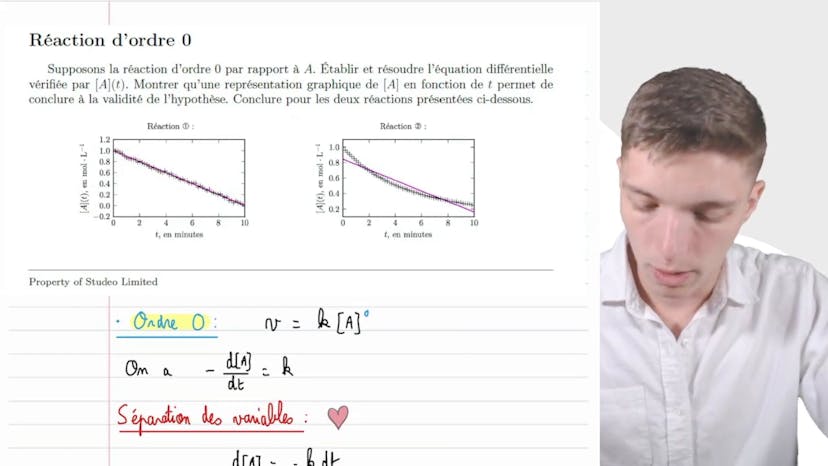
Ions iodures et ferriques
Dans cette vidéo, Matisse de Studio explique le processus d'oxydation des ions iodure par les ions fériques. Il présente une équation de bilan : 2Fe3+ + 2I- -> 2Fe2+ + I2.
Il réalise deux séries d'expériences à température constante pour déterminer les vitesses initiales en utilisant une méthode appelée "horloge à iode". Pour la première série, la concentration initiale en I- est fixée à 4x10^-3 mol/L, tandis que pour la deuxième série, c'est la concentration initiale en Fe3+ qui est fixée à 1,67x10^-3 mol/L.
Ensuite, il propose un modèle mathématique pour exprimer la vitesse initiale de réaction en fonction des concentrations initiales des réactifs. En utilisant une régression linéaire, il détermine les ordres partiels de réaction par rapport à I- (α) et par rapport à Fe3+ (β). Il obtient β = 1 et α = 2.
Il utilise également les résultats de la régression linéaire pour déterminer les constantes de vitesse apparentes (K-up et K'). Enfin, il calcule la valeur de la constante de vitesse (K) à partir de K' et de la concentration initiale en Fe3+.
En conclusion, Matisse établit la loi de vitesse initiale de la réaction étudiée : V0 = K [I-]^2 [Fe3+]^1, avec K = 4,55 mol-2 L2s-1. Il souligne que ces résultats concernent uniquement la vitesse initiale de réaction.