Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
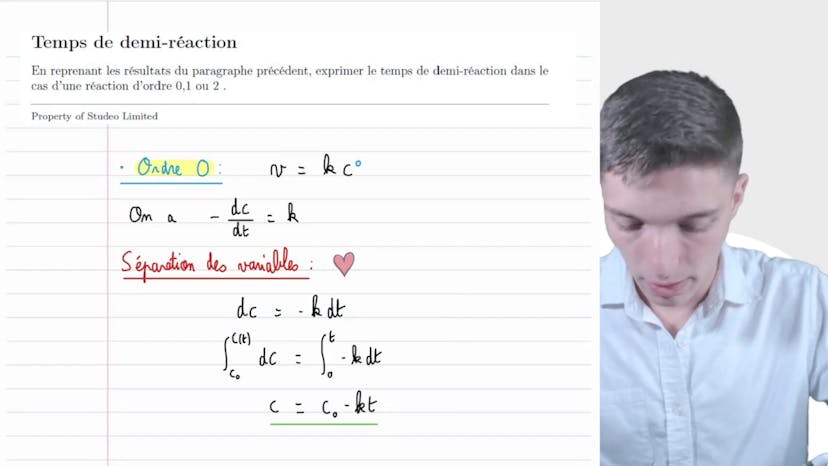
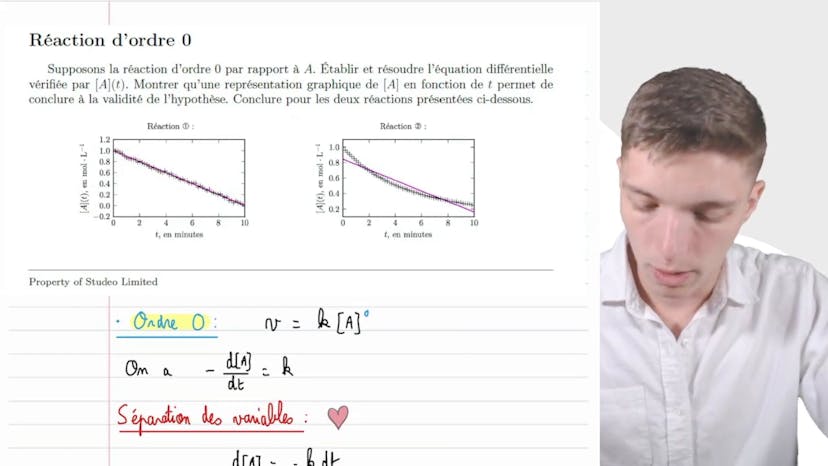
Loi d'Arrhenius
Dans cette vidéo, Mathis de Studio explique la loi d'Arenius qui concerne la décomposition du pâte à oxyde d'azote N2O5 en dioxyde azote NO2 et en dioxygène à une température de θ supérieure ou égale à 150°C. Il démontre comment écrire l'équation de la réaction en utilisant les nombres stoichiométriques appropriés.
Il poursuit en expliquant comment déterminer l'ordre alpha de la réaction et la constante cinétique K grâce à une étude cinétique menée à différentes températures. Il souligne qu'en repérant l'unité de la constante de vitesse K (exprimée en secondes moins 1), on peut déduire que l'ordre alpha de la réaction est 1. Il propose ensuite une loi de vitesse qui relie la vitesse de la réaction à la concentration de N2O5.
Ensuite, Mathis examine les données expérimentales fournies pour déterminer si elles sont compatibles avec la loi d'Arenius. Il explique comment effectuer une régression linéaire en utilisant la loi d'Arenius pour relier ln de K à 1 sur T. Les constantes obtenues dans la régression linéaire permettent de déterminer l'énergie d'activation et le facteur préexponentiel de la réaction. Les résultats obtenus sont une énergie d'activation de 15,0 kJ par mol et un facteur préexponentiel de 29,7 X 10³.
En résumé, cette vidéo explique la loi d'Arenius concernant la décomposition du N2O5, détermine l'ordre alpha et la constante cinétique K, et effectue une régression linéaire pour obtenir des valeurs pour l'énergie d'activation et le facteur préexponentiel.