Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Réfrégirateur
Aujourd'hui, nous allons résoudre un exercice sur les machines thermiques, plus précisément sur un réfrigérateur. L'exercice consiste à déterminer le travail minimal nécessaire pour transformer 1 kg d'eau liquide à 0°C en glace en utilisant un réfrigérateur. La température de la pièce dans laquelle se trouve le réfrigérateur est de 19°C et est constante.
Avant de commencer, il est important de comprendre ce que signifie "travail minimal". En thermodynamique, le fonctionnement optimal d'une machine est souvent celui qui est réversible, comme le rendement de Carnot. Ainsi, pour fournir le moins d'énergie possible, il faut connaître le fonctionnement réversible.
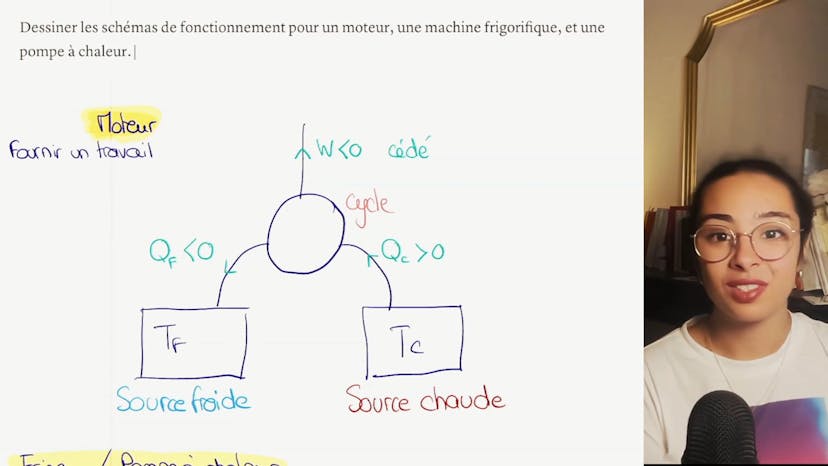
Pour cela, nous allons d'abord rappeler le fonctionnement d'un réfrigérateur. Dans un réfrigérateur, nous fournissons de l'énergie sous forme électrique. Le réfrigérateur reçoit un transfert thermique de la source froide (l'intérieur du réfrigérateur) et effectue un transfert thermique vers la source chaude (l'extérieur du réfrigérateur) où il se réchauffe.
Maintenant, passons à la transformation de l'eau en glace. Comme il s'agit d'un changement d'état, cela se fait à pression et température constantes. Pour cela, nous utiliserons la notion de chaleur latente de solidification, qui est l'opposé de la chaleur latente de fusion (l'énergie nécessaire pour faire passer de l'eau solide en eau liquide).
Le transfert thermique total reçu par l'eau sera égal à la chaleur latente de fusion multipliée par la masse de l'eau. Cela signifie que le réfrigérateur doit recevoir cette énergie. En d'autres termes, il doit recevoir la quantité d'énergie nécessaire pour solidifier l'eau.
Maintenant, nous avons deux quantités : le transfert thermique reçu par le réfrigérateur (QF) et le travail minimal (W) que nous cherchons à déterminer. Selon le premier principe de la thermodynamique, le travail minimal est égal à moins le transfert thermique reçu par le réfrigérateur. Nous pouvons aussi utiliser l'inégalité de Clausius, une application du second principe de la thermodynamique, qui nous dit que moins le transfert thermique de la source chaude divisé par sa température est plus petit que zéro.
Finalement, nous obtenons l'expression du travail minimal, qui est égal à moins la masse de l'eau multipliée par la chaleur latente de fusion divisée par la température de la source froide.
Il ne reste plus qu'à effectuer les calculs numériques pour obtenir la valeur du travail minimal, soit 23,2 kJ pour transformer 1 kg d'eau liquide en glace.
En conclusion, cet exercice nous a permis de comprendre et d'appliquer les concepts de thermodynamique, en particulier ceux liés aux machines thermiques et à la transformation d'état de l'eau. Cela nécessite une compréhension rigoureuse des signes et des équations, mais aussi une application pratique des formules.