 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Modélisation des réactions acide-base
- Analyse physique d'un système chimique
- Méthode de suivi d'un titrage
- Evolution temporelle d'une transformation chimique
- Evolution temporelle d'une transformation nucléaire
- Evolution spontanée d'un système chimique
- Equilibre acide-base
- Transformations chimiques forcées
- Structure et organisation en chimie organique
- Stratégies de synthèses
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Modélisation des réactions acide-base
- Analyse physique d'un système chimique
- Méthode de suivi d'un titrage
- Evolution temporelle d'une transformation chimique
- Evolution temporelle d'une transformation nucléaire
- Evolution spontanée d'un système chimique
- Equilibre acide-base
- Transformations chimiques forcées
- Structure et organisation en chimie organique
- Stratégies de synthèses
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
Terminale

L'acide palmitique
Dans cette vidéo, l'expert Matisse de Studio parle de l'huile de palme et explique pourquoi sa molécule est considérée comme un acide carboxylique en raison du groupe COOH qu'elle contient. Il explique également quel atome d'hydrogène est responsable de son caractère acide et comment représenter la base conjuguée de cet acide. La vidéo se termine par une invitation à s'entraîner davantage sur ce sujet.
Physique-Chimie
Chimie
Terminale

pH et dilution
Dans cette vidéo, Matisse de Studio nous explique comment calculer le pH et la dilution d'une solution d'acide sulfurique de concentration 8,0 10-2 mol par litre, que nous avons besoin de diluer cinq fois pour préparer 200 millilitres d'acide dilué. Pour calculer le pH, il faut connaitre la formule standard pH = -log[H3O+]. En utilisant le tableau d'avancement, nous avons déterminé que la concentration de l'H3O+ dans la solution mère était 2C0, alors le pH est 0,8. En utilisant la formule du facteur de dilution, nous avons déterminé la concentration de l'H3O+ dans la solution fille, qui est C0/5, puisque nous avons dilué la solution cinq fois. Le pH de la solution fille est -log(C0/5), qui est 1,5, moins acide que la solution mère.
Physique-Chimie
Chimie
Terminale

Eau minérale
Dans cette vidéo, une étude d'une eau minérale est entreprise en effectuant différentes mesures de concentration comme le pH qui est de 7,4 plus ou moins 0,2 et contient 468 mg par litre d'ion calcium. Il est déterminé que l'incertitude sur le pH est de 0,2 unité près, et cela ne pose pas de problème car c'est l'ordre de grandeur des incertitudes des relevés expérimentaux de mesure du pH. La concentration en Nuon Oxonium est obtenue en reliant le pH qui est entre 7,2 et 7,6, grâce à la formule qui montre que la concentration en H3O plus 7 égale à 10 puissance moins pH. Cette concentration en H3O plus est ensuite convertie en concentration massique en utilisant la relation entre la concentration massique et la concentration molaire. La concentration massique en H3O plus est calculée pour être entre 4,8 10,7 et 1,2 10,6 g par litre. Enfin, la concentration en ion oxonium est comparée à celle en ion calcium, et il est déterminé qu'il y a environ 300 000 fois plus d'ion calcium que d'ion oxonium dans cette bouteille.
Physique-Chimie
Chimie
Terminale
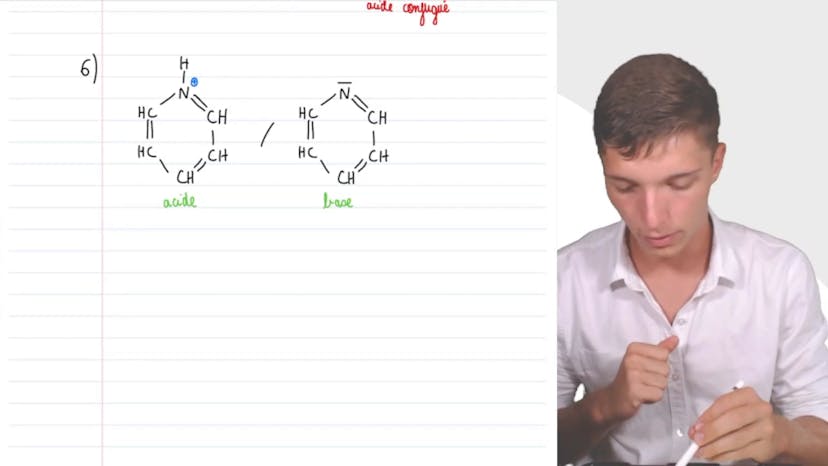
Analyse de la pyridine
Dans cette vidéo, on étudie la molécule de pyridine, utilisée en pharmacie et dans la fabrication d'insecticides. On donne le schéma de Lewis de cette molécule, qui se caractérise par un cycle à 5 atomes de carbone et 1 atome d'azote, ainsi que par son doublet non-liant. On détermine ensuite que la pyridine n'a pas de caractère acide, car aucun de ses hydrogènes ne peut être cédé. En revanche, elle a un caractère basique, car son doublet non-liant peut capter un proton H+. L'acide conjugué de la pyridine est représenté par une mini-réaction dans laquelle l'atome d'azote a perdu une charge positive, tandis que l'hydrogène est devenu neutre. Enfin, le couple acide-base de la pyridine est donné. Il est important de connaître les caractères acides et basiques des molécules pour savoir si elles peuvent interagir avec d'autres.
Physique-Chimie
Chimie
Terminale

Repérage d'acidité
Dans cette vidéo, Mathis de Studio explique l'acidité d'une molécule, en l'occurrence le 4-tert-butyl-pyro-catécole utilisé comme inhibiteur de polymérisation dans les plastiques. Il explique que selon la définition de Brosted, un acide est une molécule capable de céder un proton H+. Dans cette molécule, il y a deux hydrogènes reliés à des atomes d'oxygène qui peuvent être cédés, ce qui confère à la molécule des propriétés acides. Pour illustrer les couples acides-bases possibles, Mathis fait apparaître les bases conjuguées associées à l'acide en cédant successivement un ou deux protons. Il mentionne également que bien que cette molécule ait des caractères acides, elle n'est pas un acide carboxylique car elle ne contient pas le groupement carboxyles COOH.
Physique-Chimie
Chimie
Terminale

Beurre acide
L'acide butyrique est un acide carboxylique dérivé du butane, avec une chaîne carbonée linéaire de 4 carbones. Son nom vient du latin butyrum, signifiant beurre, en raison de son odeur caractéristique. La formule semi-développée de l'acide butyrique est H3C, CH2, CH2, COH. Le schéma de Lewis montre la double liaison oxygène avec les deux doublets non-liants, et l'oxygène avec ses deux doublets non-liants relié au carbone et à l'hydrogène. On explique que le caractère acide est déterminé par l'hydrogène relié à l'atome d'oxygène. Ensuite, on présente le butanoate de méthyl, un estère utilisé comme arôme pour son odeur de pomme, obtenu à partir de l'acide butyrique. Sa formule est CH3CH2 2 COOCH3. On explique que cet estère n'a pas de caractère acide, car on a remplacé l'hydrogène capable d'acidité par un groupement CH3. Le cours se termine en remerciant les spectateurs de leur attention.
Physique-Chimie
Chimie
Terminale

Eau minérale
Dans cette vidéo, on étudie une eau minérale en mesurant son pH et sa concentration en ion calcium. L'incertitude sur la mesure du pH est de 0,2, ce qui est habituel pour ce type de mesure. En utilisant la relation entre le pH et la concentration en Nuon Oxonium, on détermine que la concentration en H3O plus est entre 2,5 10,8 et 6,3 10,8 mol par litre. Ensuite, en utilisant la formule de la concentration massique et la masse molaire de H3O plus, on trouve que la concentration massique est entre 4,8 10,7 et 1,2 10,6 g par litre. On compare ensuite la concentration en ion oxonium trouvée avec celle en ion calcium donnée, en passant les concentrations en molaire et en faisant le rapport. On trouve alors qu'il y a environ 300 000 fois plus d'ion calcium que d'ion oxonium dans cette bouteille.
Physique-Chimie
Chimie
Terminale

Détartrage
Bonjour à tous, dans cette vidéo, nous allons aborder le sujet du détartrage. Pendant le détartrage, le carbonate de calcium, principal constituant du tartre, réagit avec l'acide lactique selon la réaction suivante : CaCO3 + 2AH -> CO2 + H2O + Ca2+(aq) + 2A-(aq). Nous allons suivre le protocole suivant : dans un ballon, nous ajoutons 10 ml de la solution de détartrage contenant de l'acide lactique, dilué 10 fois. Nous introduisons ensuite 0,2 g de carbonate de calcium. Nous fermons le ballon avec un bouchon équipé d'un tube relié à un capteur de pression pour mesurer la pression du dioxyde de carbone émis. Après 10 minutes, nous relevons une pression de 155 hectopascals et un volume de dioxyde de carbone de 310 ml. Le graphique suivant montre l'évolution du volume molaire d'un gaz en fonction de la pression à 25 degrés. Maintenant, passons aux questions. Premièrement, pourquoi la réaction étudiée est-elle une réaction acido-basique ? Dans une réaction acido-basique, il y a échange de protons entre l'acide et la base. Dans ce cas, le CO₃²- joue le rôle de la base conjuguée de l'acide CO₂ et l'acide AH a comme base conjuguée A-. Deuxièmement, est-ce que le carbonate de calcium a été complètement consommé au moment du relevé expérimental ? Pour le déterminer, nous devons utiliser le tableau d'avancement. En calculant, nous obtenons une quantité de carbonate de calcium restante de 1,8 x 10-3 mol, ce qui signifie qu'il n'a pas été complètement consommé. Ensuite, quelle est la concentration minimale en acide lactique de la solution de détartrage ? Pour répondre à cette question, nous devons déterminer la quantité d'acide lactique consommée, qui est égale à la quantité de dioxyde de carbone émis. En utilisant les valeurs données, nous trouvons une concentration minimale en acide lactique de 0,38 mol/L. Voilà, c'est la fin de cet exercice. N'ayez pas peur des grandeurs utilisées, il suffit d'appliquer les équations les plus simples et de ne pas perdre le fil de ce que nous faisons. Merci de nous avoir suivi et à bientôt !
Physique-Chimie
Chimie
Terminale

Espèce amphotère
Dans cette vidéo, nous étudions l'acide phosphorique, un triacide couramment utilisé en synthèse organique et comme régulateur de pH dans les systèmes d'irrigation. Les trois couples acides-bases auxquels il appartient sont H3PO4/H2PO4-, H2PO4-/HPO4 2-, et HPO4 2-/PO4 3-. Parmi ces espèces, seules H2PO4- et HPO4- sont amphotères, c'est-à-dire qu'elles peuvent agir à la fois comme acide et comme base dans différents couples. Cela fait d'elles des espèces intéressantes en termes d'acide-base. Merci d'avoir suivi cette vidéo et à bientôt !
Révisions Physique Lycée
Chimie
MPSI/PCSI
pH et dilution
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
L'acide palmitique
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
pH et dilution
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Eau minérale
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Analyse de la pyridine
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Repérage d'acidité
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Beurre acide
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Eau minérale
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Détartrage
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Espèce amphotère
Aucun résumé n'est disponible pour cette vidéo


