 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Corrigés de BAC
Bac Physique-Chimie
Terminale

Acoustique d’une salle (1)
Le cours aborde la diffraction des ondes lumineuses et sonores dans le contexte de l'acoustique d'une salle. Dans la première partie, on étudie une expérience sur la diffraction des ondes lumineuses, en utilisant un laser et une fente. On détermine que l'angle caractéristique de diffraction est θ = λ/a, où λ est la longueur d'onde et a est la largeur de la fente. On montre ensuite que la largeur de la tâche de diffraction est L = 2λd/a, en utilisant des approximations géométriques. On mesure la largeur L en faisant varier la taille de la fente a, et on obtient une relation linéaire de la forme L = k/a. En utilisant une autre relation donnée dans la question précédente, on exprime k en fonction de λ et D, où D est la distance entre la fente et l'écran. On nous demande ensuite de montrer que λ = 6,5x10^-7 mètres en interprétant un graphique et en calculant le coefficient directeur de la droite correspondante. On détermine également les angles θ1 et θ2 correspondant aux largeurs a1 = 38 micromètres et a2 = 150 micromètres respectivement, en utilisant la formule θ = λ/a. On conclut que la diffraction est plus marquée pour la fente de taille a1, car l'angle de diffraction θ1 est plus grand que θ2. On donne rendez-vous pour la suite du cours dans une prochaine vidéo qui abordera la diffraction sonore.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Acoustique d’une salle (2)
Dans cette vidéo, Layla de Studio aborde la dernière partie de l'exercice C du sujet Polynésie 2022 jour 1, qui traite de la diffraction des ondes sonores. Elle explique que la diffraction des ondes sonores fonctionne de la même manière que celle des ondes lumineuses et cela est étudié à travers l'acoustique d'une salle de concert.
Layla commence par expliquer que lors d'un concert, un élève constate qu'il perçoit mieux les sons graves de fréquence f1 (200 hertz) que les sons aigus de fréquence f2 (1 kilohertz). Pour comprendre cela, elle rappelle la formule pour exprimer la longueur d'onde lambda d'une onde sonore en fonction de la vitesse du son V son et de la fréquence f, qui est lambda = V son / f.
En utilisant cette formule, Layla montre que les longueurs d'onde lambda 1 (pour f1) et lambda 2 (pour f2) ont des valeurs respectives de 1,70 mètres et 0,340 mètres, en appliquant les valeurs données dans l'énoncé.
Ensuite, Layla présente la situation à laquelle l'élève doit réfléchir. Il y a une scène de concert avec un pilier important pour l'étude acoustique. L'élève peut se trouver à trois positions : A, B ou C. Il doit choisir la position qui correspond le mieux à sa perception des sons graves par rapport aux sons aigus.
Pour cela, Layla explique que la diffraction joue un rôle crucial. En utilisant le pilier comme obstacle, la diffraction se produit différemment selon les fréquences. Si la largeur du pilier est beaucoup plus petite que la longueur d'onde, la diffraction se produit de manière similaire à celle d'une fente étroite dans une expérience de diffraction de la lumière.
Layla explique que les sons graves, avec une longueur d'onde plus élevée (lambda 1 ), seront plus diffractés que les sons aigus, avec une longueur d'onde plus petite (lambda 2). Elle visualise les différentes positions (A, B et C) par rapport au pilier et explique que la position C correspondrait le mieux à la situation décrite par l'élève lors du concert, car les sons graves seront plus diffractés, mais les sons aigus peuvent ne pas être perceptibles.
Layla conclut en soulignant que cet exercice nécessite une application des connaissances sur les ondes lumineuses et une analogie avec les ondes sonores. Elle espère que cet exercice a été utile et encourage les personnes à continuer à réviser pour le bac de physique qui approche.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le colorant E127 (1)
Aujourd'hui, nous allons étudier le colorant E127 à travers un exercice de chimie organique. Ce colorant est utilisé pour teinter certains aliments et est également présent dans les médicaments, notamment dans les révélateurs de plaques dentaires.
Dans un premier temps, nous devons déterminer la formule topologique de l'erythrosine (E127) et identifier les familles fonctionnelles associées aux différents groupes caractéristiques présents dans la molécule. Nous trouvons notamment les groupes hydroxyle, carbonyl et carboxyle, correspondants respectivement aux fonctions alcool, cétone et acide carboxylique.
Ensuite, nous devons justifier la forme prédominante de l'erythrosine présente dans le révélateur de plaques dentaires. Pour cela, nous devons examiner les pH et les pKa de la molécule. En analysant ces données, nous pouvons établir un diagramme de prédominance et constater que la forme prédominante est H2ERY-.
Nous passons ensuite à un dosage spectrophotométrique pour déterminer la concentration en colorant dans le révélateur de plaques dentaires. En utilisant les données expérimentales et la loi de Beer-Lambert, nous pouvons calculer la concentration de la solution S, qui est de 5,5 µmol/L. Cependant, il est essentiel de prendre en compte les étapes précédentes de dilution avant d'obtenir la valeur recherchée, qui est de 2,2 x 10-2 mol/L pour la solution mère.
Enfin, nous devons déterminer le titre massique en colorant E127. Pour cela, nous utilisons la formule PM = C0M/Rho, où PM représente le titre massique, C0 la concentration, M la masse molaire et Rho la masse volumique de l'eau. En effectuant les calculs appropriés, nous trouvons que le titre massique est de 1,9%.
Il est important de noter que cette valeur est proche de la concentration de 2% mentionnée dans l'énoncé initial, ce qui confirme la justesse de nos calculs.
En résumé, cet exercice de chimie organique porte sur la synthèse et l'analyse du colorant E127. Nous avons étudié sa formule topologique, les familles fonctionnelles associées, la forme prédominante dans le révélateur de plaques dentaires, ainsi que sa concentration et son titre massique dans cette solution.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le colorant E127 (2)
Le cours présente la partie 2 d'une synthèse organique réalisée à partir d'un colorant. Dans cette partie, l'objectif est de synthétiser la molécule recherchée, l'érythrosine, à partir de la fluorescine. Le cours explique les différentes étapes de la synthèse et leur rôle, dont la transformation chimique de synthèse, la filtration et le lavage du solide obtenu, et la mesure de la température de fusion pour identifier le produit de la synthèse.
Ensuite, il aborde les facteurs cinétiques pour optimiser la vitesse de formation, notamment le chauffage à reflux. Le réactif limitant de la synthèse de l'érythrosine est déterminé à l'aide d'un tableau d'avancement, en comparant les quantités consommées des réactifs. Le calcul du rendement permet ensuite de déterminer la masse formée expérimentalement.
Enfin, le cours conclut en expliquant comment déterminer le nombre de flacons de pH 7 et d'une certaine concentration qui peuvent être fabriqués avec la synthèse réalisée, en convertissant la masse en quantité de matière et en utilisant la concentration et le volume des flacons.
Le résumé SEO-friendly de ce cours est le suivant : Le cours présente la deuxième partie d'une synthèse organique de l'érythrosine à partir de la fluorescine. Il explique le rôle des différentes étapes de la synthèse, l'optimisation de la vitesse de formation, la détermination du réactif limitant et la calcul du rendement. Le cours conclut en expliquant comment déterminer le nombre de flacons pouvant être fabriqués avec la synthèse.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le colorant E127 (3)
Leïla de Studio donne une dernière partie d'un exercice sur le colorant E127, qui concerne la décoloration d'une solution de ce colorant en utilisant de l'eau de Javel. Deux expériences sont réalisées, une avec de l'eau de Javel diluée et l'autre avec de l'eau de Javel pure. La concentration en quantité de matière du colorant est mesurée au cours du temps pour les deux expériences. Dans la première partie de l'exercice, il est demandé de décrire qualitativement l'évolution de la vitesse de disparition du colorant au cours du temps pour l'expérience A. Ensuite, il est demandé de proposer un facteur cinétique expliquant cette évolution. Dans la deuxième partie de l'exercice, il est demandé de déterminer graphiquement le temps de demi-réaction pour l'expérience A et de le commenter. Enfin, il est demandé de proposer une méthode pour optimiser la décoloration du filtre Buchner, en utilisant les informations des expériences A et B. L'utilisation de l'eau de Javel pure est proposée comme méthode pour augmenter la vitesse de réaction.
Corrigés de BAC
Bac Physique-Chimie
Terminale

La physique du jonglage
Aucun résumé n'est disponible pour cette vidéo
Corrigés de BAC
Bac Physique-Chimie
Terminale

Refroidissement d’un fer à cheval
Le cours porte sur le refroidissement d'un fer à cheval en utilisant les principes de la thermodynamique. La première partie du cours traite du chauffage du fer et explique comment calculer la masse et la variation d'énergie interne du fer lorsqu'il est chauffé. On apprend également que lorsque l'énergie interne augmente, cela signifie que l'énergie cinétique microscopique des atomes de fer augmente.
La deuxième partie du cours aborde le refroidissement du fer. On examine d'abord le refroidissement à l'air libre en utilisant la loi de Newton pour les transferts thermiques. On applique ensuite le premier principe de la thermodynamique pour trouver l'équation différentielle qui régit l'évolution de la température du fer lorsqu'il perd de la chaleur à l'air. On vérifie ensuite que la fonction proposée dans la solution de l'équation différentielle est bien correcte et on calcule la température du fer après un certain temps.
Ensuite, le cours se penche sur le refroidissement du fer dans l'eau. On utilise à nouveau le modèle précédent, mais en prenant en compte le coefficient H de la loi de Newton pour l'eau. On trouve la durée
Corrigés de BAC
Bac Physique-Chimie
Terminale
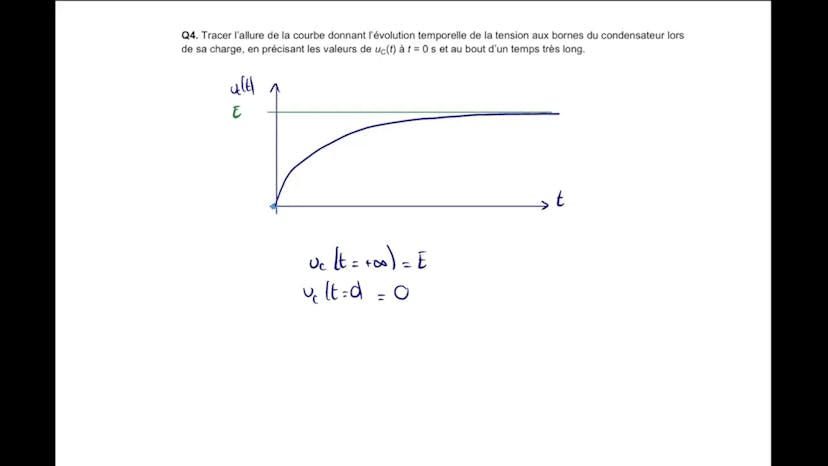
Défibrilateur cardiaque
Dans ce cours, Leïla présente l'exercice C du bac de l'année précédente qui porte sur un circuit RC modélisant un défibrillateur cardiaque. Le circuit est composé d'un générateur, d'un interrupteur, d'une résistance équivalente à celle du thorax du patient et d'un condensateur.
Elle commence par expliquer que pour charger le condensateur, l'interrupteur doit être positionné en position 1, afin de mettre le générateur et le condensateur dans la même boucle. Elle montre ensuite comment obtenir l'équation différentielle en utilisant la loi des mailles et les lois de fonctionnement de chaque composant. L'équation obtenue est : RCDUC/dt + UC = U.
Leïla explique ensuite comment vérifier que la solution de l'équation est correcte en utilisant les expressions précédemment obtenues et en les injectant dans l'équation différentielle. Elle montre également comment déterminer le taux de charge (ou taux C) en se basant sur l'argument de l'exponentielle dans la solution. Le taux de charge a la même unité que le temps.
Ensuite, Leïla trace la courbe temporelle de l'évolution de la tension du condensateur, montrant qu'elle croît exponentiellement jusqu'à atteindre une valeur finale E. Elle démontre également que le condensateur atteint 99% de sa valeur finale à T1 égale à 5 taux C.
Le cours se poursuit avec l'étude de la décharge du condensateur, représentant une défibrillation. Leïla explique comment déterminer graphiquement le moment où l'interrupteur bascule de la position 1 à la position 2, correspondant au début de la décharge. Elle montre également comment obtenir le temps caractéristique de décharge (taux graphe), en traçant la tangente à l'origine et en déterminant son intersection avec l'axe des temps.
Enfin, Leïla aborde la durée nécessaire de décharge du condensateur dans des conditions normales d'utilisation. Elle rappelle que la décharge est terminée au bout de 5 taux décharge (5 RC). En utilisant la plage de résistance du corps humain (50 Ohm à 150 Ohm), elle estime que la durée de décharge se situe entre 0,043 secondes et 0,128 secondes, ce qui est bien inférieur aux 4 secondes maximum prévues.
Le cours se termine sur l'invitation à regarder les autres vidéos pour les exercices A et B du sujet, puisqu
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le sel d’oseille (1)
Dans cette vidéo, Layla présente le premier exercice d'un sujet de BAC de chimie sur le sel d'oxalate. Elle explique que le sel d'oxalate est une substance chimique sous forme de cristaux blancs et incolores. Sa nomenclature officielle est l'acide oxalique. L'objectif de l'exercice est de valider deux hypothèses sur le type d'acidité de cet acide. On cherche également à connaître son utilisation dans la vie courante.
Dans la première partie de l'exercice, on étudie la première hypothèse selon laquelle l'acide oxalique est un diacide fort. Layla explique la définition d'une espèce acide selon Brønsted, qui peut libérer un proton H+. On peut également avoir affaire à des acides de Lewis, qui sont liés au doublé électronique. L'acide oxalique est un diacide car il peut libérer deux protons H+. Layla présente la représentation de Lewis de l'acide oxalique et explique que les atomes d'hydrogène dans la molécule sont acides en raison de la polarisation de la liaison. Les deux couples acides-bases associés à l'acide oxalique sont donnés, et on souligne la présence d'une espèce amphothère.
Dans la partie expérimentale, Layla explique comment modéliser la transformation chimique entre l'acide oxalique et l'eau en émettant l'hypothèse que c'est un diacide fort. L'équation modélisant cette transformation est présentée, en indiquant que la réaction est totale. On demande ensuite de calculer la concentration en ion hydronium (H3O+) et de déduire le pH théorique de la solution. Layla utilise un tableau d'avancement pour déterminer l'avancement maximal de la réaction et déduire la concentration en H3O+. Finalement, le pH théorique est calculé, mais il est différent du pH expérimental indiqué précédemment. Cela remet en question l'hypothèse selon laquelle l'acide oxalique est un acide fort, car il reste de l'acide à l'état final.
En conclusion, cette première partie de l'exercice remet en cause l'hypothèse selon laquelle l'acide oxalique est un acide fort. La prochaine vidéo abordera l'autre hypothèse selon laquelle c'est un acide faible.
Corrigés de BAC
Bac Physique-Chimie
Terminale
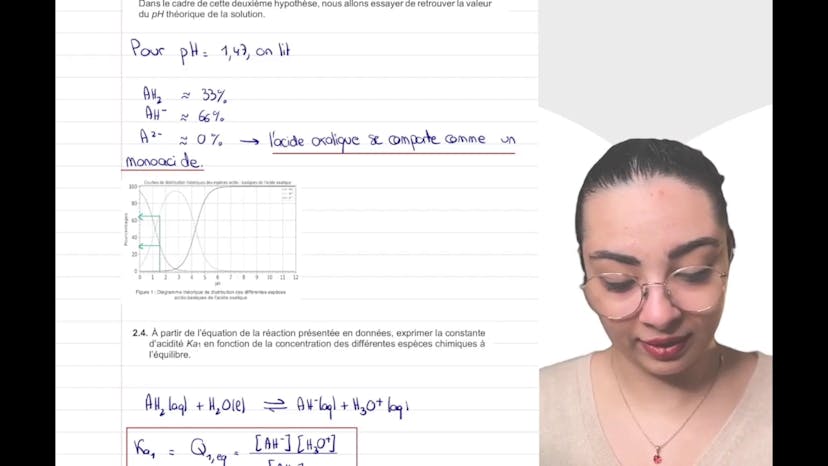
Le sel d’oseille (2)
Le sujet de ce cours porte sur les diacides, en particulier sur l'acide oxalique. Dans une vidéo précédente, on a émis l'hypothèse que l'acide oxalique était un diacide fort, mais cette hypothèse a été invalidée par des expériences détaillées dans la vidéo précédente. Une deuxième hypothèse est donc formulée : l'acide oxalique est considéré comme un monoacide faible en solution. On étudie les concentrations en acide apporté, le pKa (première acidité de l'acide oxalique) et la réaction associée. On rappelle également que le pH de la solution est de 1,47. On demande ensuite d'écrire l'équation modélisée de la transformation de l'espèce AH- avec de l'eau. En utilisant la figure 1, on détermine ensuite le pKa de la deuxième acidité de l'acide oxalique, qui est d'environ 4,3. On utilise ensuite la courbe de distribution théorique pour donner le pourcentage approximatif de chaque espèce présente dans la solution. On constate que seule la forme AH2 et AH- sont présentes, tandis que la forme A2- est négligeable. On peut donc considérer que l'acide oxalique se comporte comme un monoacide faible. On passe ensuite à l'aspect théorique en exprimant la constante d'acidité K1 en fonction des concentrations des espèces à l'équilibre. On introduit également l'équation du second degré et on utilise un code Python pour calculer la concentration en oxonium (H3O+). Ce code Python résout l'équation du second degré et donne un pH final très proche de la valeur expérimentale. On conclut en validant l'hypothèse que l'acide oxalique se comporte comme un monoacide faible. Dans la prochaine vidéo, on abordera la partie 3 de cet exercice.
Corrigés de BAC
Bac Physique-Chimie
Terminale
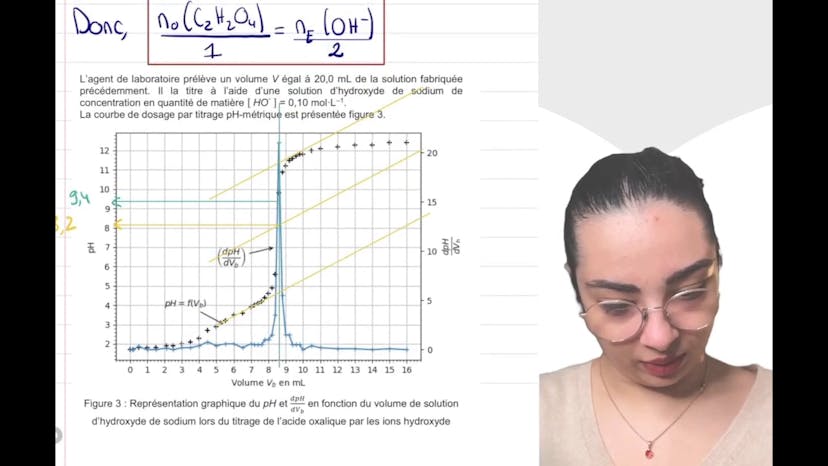
Le sel d’oseille (3)
Le cours porte sur l'acide oxalique et ses différentes formes (pure et hydratée). Le problème à résoudre est de déterminer si un solide blanc trouvé dans un récipient contient de l'acide oxalique hydraté ou pur. Pour cela, un titrage par suivi pH métrique est effectué sur une solution aqueuse.
Dans un premier temps, la concentration massique de la solution est calculée en prenant en compte les conditions expérimentales et leur incertitude. L'équation support du titrage est donnée pour trouver cette concentration.
La justifications du coefficient 2 devant l'ion hydroxyde de l'équation de la réaction est expliquée en considérant que l'acide oxalique est un diacide qui nécessite deux ions H+ pour réagir.
Afin d'utiliser un dosage par titrage direct, il est nécessaire que la transformation chimique soit unique, totale et rapide. D'autres méthodes expérimentales peuvent également être utilisées pour déterminer les concentrations.
La relation entre les quantités de matière en espèce titrée et titrante à l'équivalence est donnée par la proportion stoichiométrique des réactifs.
Pour déterminer le pH à l'équivalence, deux méthodes sont présentées. La première consiste à observer le pic de la dérivée de la courbe de pH en fonction du volume. La seconde utilise la méthode des tangentes pour trouver le pH au point médian entre les deux tangentes tracées. Selon ces méthodes, les valeurs de pH à l'équivalence sont respectivement de 9,2 et 8,2.
En choisissant un indicateur coloré, il est préférable de prendre en compte les deux sauts de pH observés. La phénolphthaleine est recommandée car elle couvre les deux domaines de changement de couleur.
Finalement, en utilisant les résultats du titrage, la concentration en quantité de matière d'acide oxalique est déterminée, puis on peut conclure si l'acide est hydraté ou non. En comparant la concentration massique obtenue avec les valeurs fournies au début de l'exercice, on peut conclure que l'acide oxalique est hydraté.
Il est recommandé d'exploiter les résultats du titrage et de considérer les concentrations massiques pour répondre aux questions sur l'hydratation de l'acide oxalique.
Corrigés de BAC
Bac Physique-Chimie
Terminale
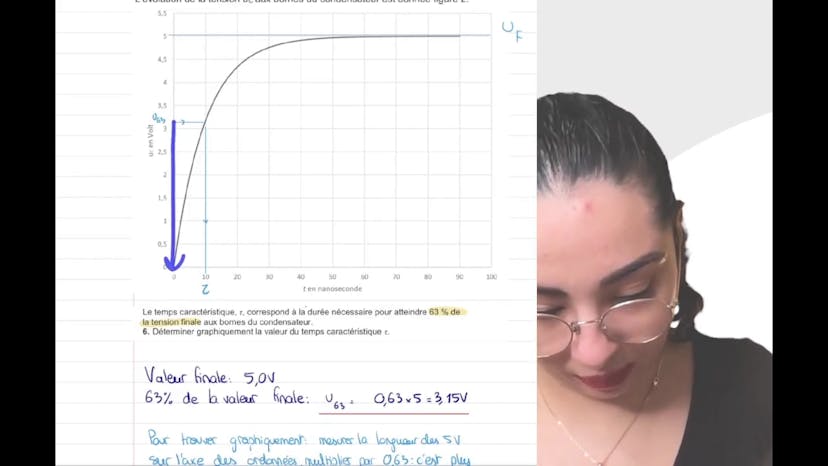
Un capteur capacitif
Dans ce cours, nous étudions l'exercice d'électricité sur le capteur capacitif qui est tombé au bac l'année dernière. Nous commençons par l'étude théorique de la charge d'un dipôle RC en utilisant la loi des mailles et la loi d'Ohm. Ensuite, nous établissons l'expression reliant le courant d'intensité I, la tension UC et la capacité C du condensateur. En utilisant ces relations, nous pouvons déterminer l'équation différentielle qui régit l'évolution de la tension UC au borne du condensateur. Nous passons ensuite à l'étude expérimentale de la charge en utilisant un montage avec une résistance donnée. Nous déterminons graphiquement le temps caractéristique tau et calculons la valeur de la capacité C du condensateur. Ensuite, nous nous intéressons au condensateur à capacité variable et décrivons son évolution si on rapproche l'armature mobile de l'armature fixe. Enfin, nous expliquons comment utiliser ce montage pour contrôler l'épaisseur d'une colle en mesurant la capacité du condensateur.


