All subjects
All subjects
 All subjects
All subjects
Le sel d’oseille (1)
Dans ce cours, Layla de Studéo présente le premier exercice d'un sujet de BAC de chimie sur le sel d'osaïe. Elle commence par expliquer que le sel d'osaïe est en réalité l'acide oxalique, une substance chimique utilisée dans de nombreuses synthèses. L'objectif de l'exercice est de déterminer si l'acide oxalique est un acide fort ou un acide faible.
Layla explique ensuite la définition d'une espèce acide selon Brønsted, qui libère un proton H+, et d'une base de Brønsted, qui capte un proton H+. Elle mentionne également les acides de Lewis, liés au doublé électronique.
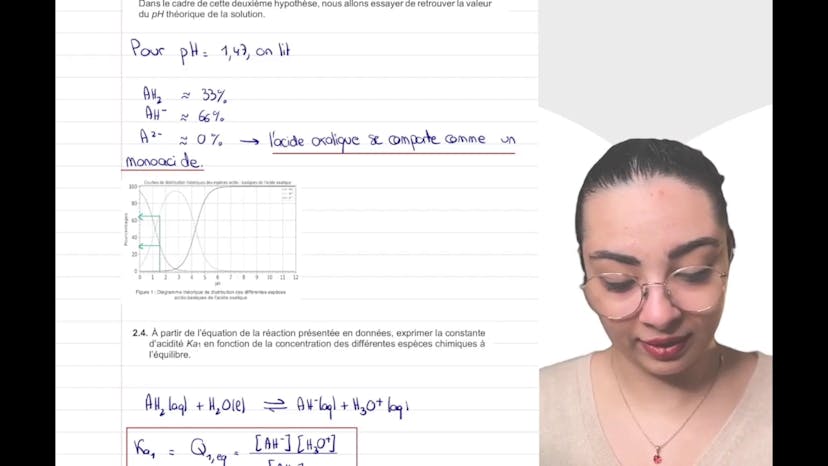
Elle poursuit en montrant la représentation de Lewis de l'acide oxalique et en expliquant pourquoi il est considéré comme un diacide, capable de libérer deux protons H+. Elle donne également les deux couples acides-bases associés à l'acide oxalique.
Dans la partie expérimentale, Layla modélise la transformation chimique entre l'acide oxalique et l'eau en supposant que c'est un diacide fort. Elle écrit l'équation de la réaction et utilise un tableau d'avancement pour déduire la concentration en H3O+. Elle trouve une concentration de 1*10^-1 mol par litre.
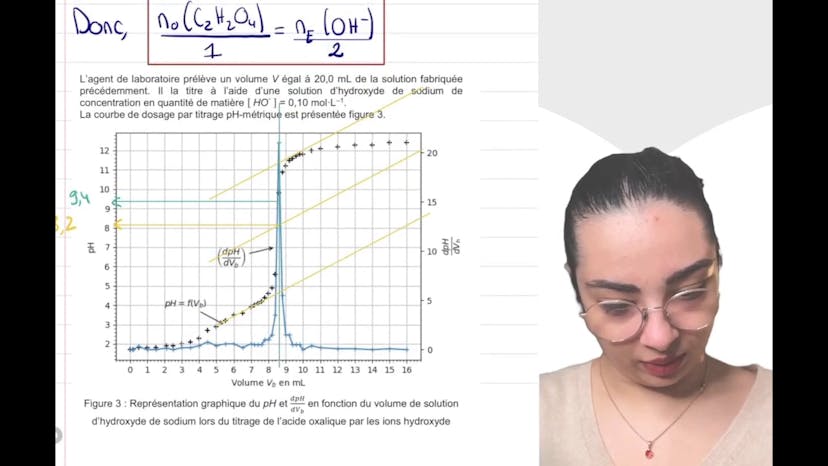
En comparant le pH théorique calculé à partir de la concentration en H3O+ avec le pH expérimental, Layla conclut que l'hypothèse selon laquelle l'acide oxalique est un acide fort n'est pas valide. En effet, la solution est moins acide que prévu, ce qui indique une réaction incomplète et donc, que l'acide oxalique est un acide faible.
Layla annonce ensuite qu'elle étudiera cette autre hypothèse dans une prochaine vidéo.
Résumé : Layla de Studéo présente le premier exercice d'un sujet de BAC de chimie sur l'acide oxalique. Elle explique les concepts de base et utilise un tableau d'avancement pour déterminer si l'acide oxalique est un acide fort ou faible. Elle conclut que c'est un acide faible.