All subjects
All subjects
 All subjects
All subjects
Le sel d’oseille (3)
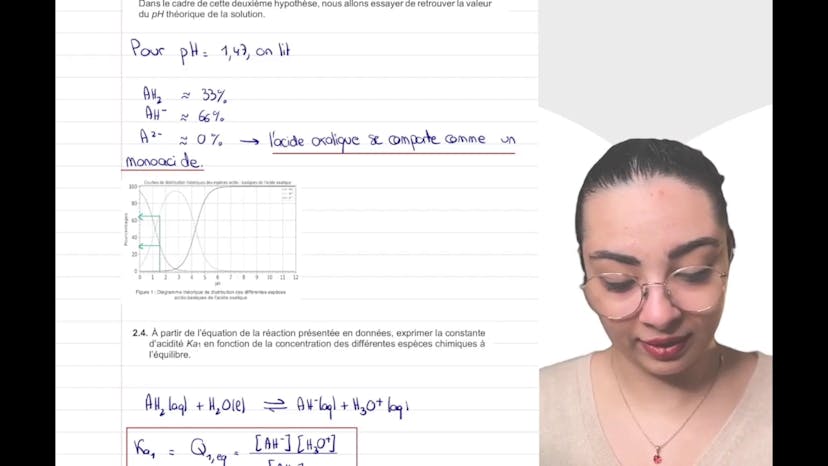
Ce cours concerne l'étude de l'acide oxalique et de ses réactions. On cherche à déterminer si un solide est de forme pure ou hydratée grâce à un titrage par suivi pH métrique. On calcule d'abord la concentration massique avec ses incertitudes. Ensuite, on justifie le coefficient 2 devant l'ion hydroxyde dans l'équation de réaction, en se basant sur le fait que l'acide oxalique est un diacide. On explique également les conditions nécessaires pour utiliser un titrage direct. On donne ensuite la relation entre les quantités de matière en espèce titrée et titrante à l'équivalence. On détermine le pH à l'équivalence en utilisant soit la dérivée de la courbe pH-volume, soit la méthode des tangentes. On choisit un indicateur coloré qui couvre les deux sauts de pH. En utilisant le résultat du titrage, on calcule la concentration en quantité de matière en acide oxalique et on détermine s'il est hydraté ou non. On compare les concentrations massiques et on conclut que l'acide oxalique est hydraté. Le lien entre les concentrations massiques et la détermination de l'hydratation a été réalisé grâce à l'aspect prise d'initiative. Ce cours peut être complété par d'autres vidéos traitant des exercices de physique A, B et C.