All subjects
All subjects
 All subjects
All subjects
Le sel d’oseille (1)
Dans cette vidéo, Layla présente le premier exercice d'un sujet de BAC de chimie sur le sel d'oxalate. Elle explique que le sel d'oxalate est une substance chimique sous forme de cristaux blancs et incolores. Sa nomenclature officielle est l'acide oxalique. L'objectif de l'exercice est de valider deux hypothèses sur le type d'acidité de cet acide. On cherche également à connaître son utilisation dans la vie courante.
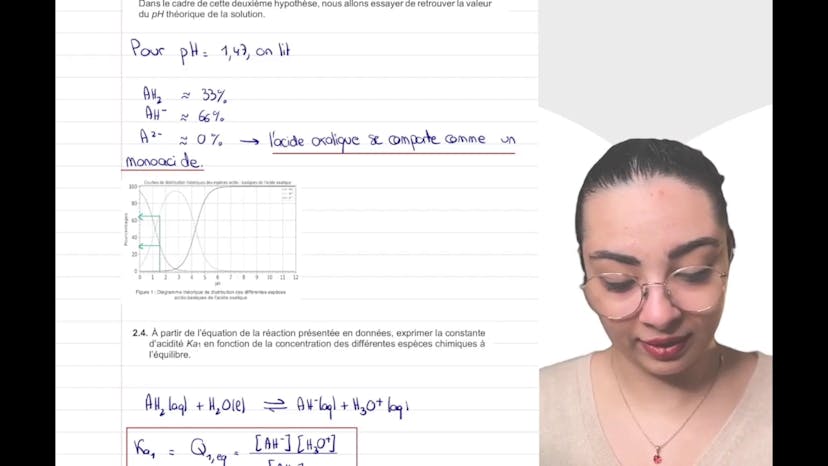
Dans la première partie de l'exercice, on étudie la première hypothèse selon laquelle l'acide oxalique est un diacide fort. Layla explique la définition d'une espèce acide selon Brønsted, qui peut libérer un proton H+. On peut également avoir affaire à des acides de Lewis, qui sont liés au doublé électronique. L'acide oxalique est un diacide car il peut libérer deux protons H+. Layla présente la représentation de Lewis de l'acide oxalique et explique que les atomes d'hydrogène dans la molécule sont acides en raison de la polarisation de la liaison. Les deux couples acides-bases associés à l'acide oxalique sont donnés, et on souligne la présence d'une espèce amphothère.
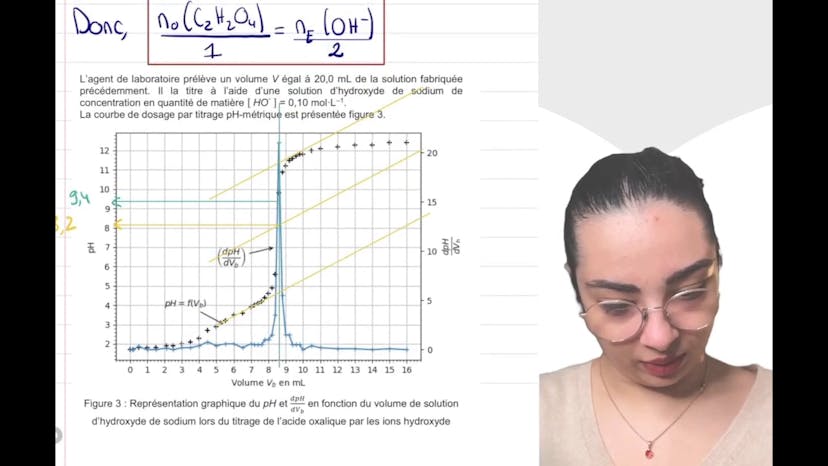
Dans la partie expérimentale, Layla explique comment modéliser la transformation chimique entre l'acide oxalique et l'eau en émettant l'hypothèse que c'est un diacide fort. L'équation modélisant cette transformation est présentée, en indiquant que la réaction est totale. On demande ensuite de calculer la concentration en ion hydronium (H3O+) et de déduire le pH théorique de la solution. Layla utilise un tableau d'avancement pour déterminer l'avancement maximal de la réaction et déduire la concentration en H3O+. Finalement, le pH théorique est calculé, mais il est différent du pH expérimental indiqué précédemment. Cela remet en question l'hypothèse selon laquelle l'acide oxalique est un acide fort, car il reste de l'acide à l'état final.
En conclusion, cette première partie de l'exercice remet en cause l'hypothèse selon laquelle l'acide oxalique est un acide fort. La prochaine vidéo abordera l'autre hypothèse selon laquelle c'est un acide faible.