 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amérique Nord 2
- Centres étrangers 1
- Centres étrangers 2
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amerique Nord 2
- Centres étrangers 1
- Centre étrangers 2
- Polynésie 1
- Polynésie 2
- Métropole 1
- Métropole 2
- Amérique Sud 1
- Amérique Sud 2
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amérique Nord 2
- Centres étrangers 1
- Centres étrangers 2
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amerique Nord 2
- Centres étrangers 1
- Centre étrangers 2
- Polynésie 1
- Polynésie 2
- Métropole 1
- Métropole 2
- Amérique Sud 1
- Amérique Sud 2
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le colorant E127 (1)
Aujourd'hui, nous allons étudier le colorant E127 à travers un exercice de chimie organique. Ce colorant est utilisé pour teinter certains aliments et est également présent dans les médicaments, notamment dans les révélateurs de plaques dentaires.
Dans un premier temps, nous devons déterminer la formule topologique de l'erythrosine (E127) et identifier les familles fonctionnelles associées aux différents groupes caractéristiques présents dans la molécule. Nous trouvons notamment les groupes hydroxyle, carbonyl et carboxyle, correspondants respectivement aux fonctions alcool, cétone et acide carboxylique.
Ensuite, nous devons justifier la forme prédominante de l'erythrosine présente dans le révélateur de plaques dentaires. Pour cela, nous devons examiner les pH et les pKa de la molécule. En analysant ces données, nous pouvons établir un diagramme de prédominance et constater que la forme prédominante est H2ERY-.
Nous passons ensuite à un dosage spectrophotométrique pour déterminer la concentration en colorant dans le révélateur de plaques dentaires. En utilisant les données expérimentales et la loi de Beer-Lambert, nous pouvons calculer la concentration de la solution S, qui est de 5,5 µmol/L. Cependant, il est essentiel de prendre en compte les étapes précédentes de dilution avant d'obtenir la valeur recherchée, qui est de 2,2 x 10-2 mol/L pour la solution mère.
Enfin, nous devons déterminer le titre massique en colorant E127. Pour cela, nous utilisons la formule PM = C0M/Rho, où PM représente le titre massique, C0 la concentration, M la masse molaire et Rho la masse volumique de l'eau. En effectuant les calculs appropriés, nous trouvons que le titre massique est de 1,9%.
Il est important de noter que cette valeur est proche de la concentration de 2% mentionnée dans l'énoncé initial, ce qui confirme la justesse de nos calculs.
En résumé, cet exercice de chimie organique porte sur la synthèse et l'analyse du colorant E127. Nous avons étudié sa formule topologique, les familles fonctionnelles associées, la forme prédominante dans le révélateur de plaques dentaires, ainsi que sa concentration et son titre massique dans cette solution.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le colorant E127 (2)
Le cours présente la partie 2 d'une synthèse organique réalisée à partir d'un colorant. Dans cette partie, l'objectif est de synthétiser la molécule recherchée, l'érythrosine, à partir de la fluorescine. Le cours explique les différentes étapes de la synthèse et leur rôle, dont la transformation chimique de synthèse, la filtration et le lavage du solide obtenu, et la mesure de la température de fusion pour identifier le produit de la synthèse.
Ensuite, il aborde les facteurs cinétiques pour optimiser la vitesse de formation, notamment le chauffage à reflux. Le réactif limitant de la synthèse de l'érythrosine est déterminé à l'aide d'un tableau d'avancement, en comparant les quantités consommées des réactifs. Le calcul du rendement permet ensuite de déterminer la masse formée expérimentalement.
Enfin, le cours conclut en expliquant comment déterminer le nombre de flacons de pH 7 et d'une certaine concentration qui peuvent être fabriqués avec la synthèse réalisée, en convertissant la masse en quantité de matière et en utilisant la concentration et le volume des flacons.
Le résumé SEO-friendly de ce cours est le suivant : Le cours présente la deuxième partie d'une synthèse organique de l'érythrosine à partir de la fluorescine. Il explique le rôle des différentes étapes de la synthèse, l'optimisation de la vitesse de formation, la détermination du réactif limitant et la calcul du rendement. Le cours conclut en expliquant comment déterminer le nombre de flacons pouvant être fabriqués avec la synthèse.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le colorant E127 (3)
Leïla de Studio donne une dernière partie d'un exercice sur le colorant E127, qui concerne la décoloration d'une solution de ce colorant en utilisant de l'eau de Javel. Deux expériences sont réalisées, une avec de l'eau de Javel diluée et l'autre avec de l'eau de Javel pure. La concentration en quantité de matière du colorant est mesurée au cours du temps pour les deux expériences. Dans la première partie de l'exercice, il est demandé de décrire qualitativement l'évolution de la vitesse de disparition du colorant au cours du temps pour l'expérience A. Ensuite, il est demandé de proposer un facteur cinétique expliquant cette évolution. Dans la deuxième partie de l'exercice, il est demandé de déterminer graphiquement le temps de demi-réaction pour l'expérience A et de le commenter. Enfin, il est demandé de proposer une méthode pour optimiser la décoloration du filtre Buchner, en utilisant les informations des expériences A et B. L'utilisation de l'eau de Javel pure est proposée comme méthode pour augmenter la vitesse de réaction.
Corrigés de BAC
Bac Physique-Chimie
Terminale

La physique du jonglage
Aucun résumé n'est disponible pour cette vidéo
Corrigés de BAC
Bac Physique-Chimie
Terminale

Refroidissement d’un fer à cheval
Le cours porte sur le refroidissement d'un fer à cheval en utilisant les principes de la thermodynamique. La première partie du cours traite du chauffage du fer et explique comment calculer la masse et la variation d'énergie interne du fer lorsqu'il est chauffé. On apprend également que lorsque l'énergie interne augmente, cela signifie que l'énergie cinétique microscopique des atomes de fer augmente.
La deuxième partie du cours aborde le refroidissement du fer. On examine d'abord le refroidissement à l'air libre en utilisant la loi de Newton pour les transferts thermiques. On applique ensuite le premier principe de la thermodynamique pour trouver l'équation différentielle qui régit l'évolution de la température du fer lorsqu'il perd de la chaleur à l'air. On vérifie ensuite que la fonction proposée dans la solution de l'équation différentielle est bien correcte et on calcule la température du fer après un certain temps.
Ensuite, le cours se penche sur le refroidissement du fer dans l'eau. On utilise à nouveau le modèle précédent, mais en prenant en compte le coefficient H de la loi de Newton pour l'eau. On trouve la durée
Corrigés de BAC
Bac Physique-Chimie
Terminale
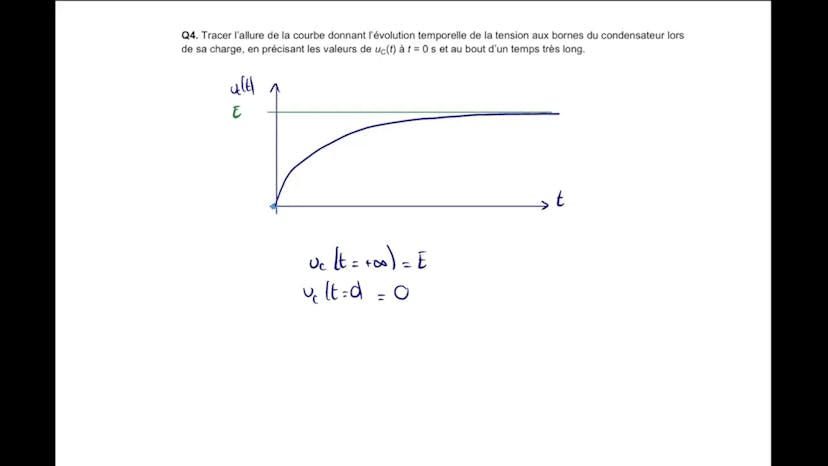
Défibrilateur cardiaque
Dans ce cours, Leïla présente l'exercice C du bac de l'année précédente qui porte sur un circuit RC modélisant un défibrillateur cardiaque. Le circuit est composé d'un générateur, d'un interrupteur, d'une résistance équivalente à celle du thorax du patient et d'un condensateur.
Elle commence par expliquer que pour charger le condensateur, l'interrupteur doit être positionné en position 1, afin de mettre le générateur et le condensateur dans la même boucle. Elle montre ensuite comment obtenir l'équation différentielle en utilisant la loi des mailles et les lois de fonctionnement de chaque composant. L'équation obtenue est : RCDUC/dt + UC = U.
Leïla explique ensuite comment vérifier que la solution de l'équation est correcte en utilisant les expressions précédemment obtenues et en les injectant dans l'équation différentielle. Elle montre également comment déterminer le taux de charge (ou taux C) en se basant sur l'argument de l'exponentielle dans la solution. Le taux de charge a la même unité que le temps.
Ensuite, Leïla trace la courbe temporelle de l'évolution de la tension du condensateur, montrant qu'elle croît exponentiellement jusqu'à atteindre une valeur finale E. Elle démontre également que le condensateur atteint 99% de sa valeur finale à T1 égale à 5 taux C.
Le cours se poursuit avec l'étude de la décharge du condensateur, représentant une défibrillation. Leïla explique comment déterminer graphiquement le moment où l'interrupteur bascule de la position 1 à la position 2, correspondant au début de la décharge. Elle montre également comment obtenir le temps caractéristique de décharge (taux graphe), en traçant la tangente à l'origine et en déterminant son intersection avec l'axe des temps.
Enfin, Leïla aborde la durée nécessaire de décharge du condensateur dans des conditions normales d'utilisation. Elle rappelle que la décharge est terminée au bout de 5 taux décharge (5 RC). En utilisant la plage de résistance du corps humain (50 Ohm à 150 Ohm), elle estime que la durée de décharge se situe entre 0,043 secondes et 0,128 secondes, ce qui est bien inférieur aux 4 secondes maximum prévues.
Le cours se termine sur l'invitation à regarder les autres vidéos pour les exercices A et B du sujet, puisqu
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Le colorant E127 (1)
Aujourd'hui, nous allons étudier le colorant E127 utilisé dans certains aliments et médicaments. Ce colorant est ionique et a une forme complexe. Nous allons d'abord étudier les différentes familles fonctionnelles présentes dans sa formule topologique. Ensuite, nous allons analyser les différentes formes du colorant en fonction du pH. Nous allons également doser ce colorant dans un révélateur de plaques dentaires pour déterminer sa concentration. Pour cela, nous utilisons la loi de Beer-Lambert et exploitons les données expérimentales. Nous justifions également la couleur rouge du révélateur en fonction de son spectre d'absorption. Enfin, nous calculons la concentration molaire et le titre massique du colorant dans le révélateur. La concentration molaire est de 2,2 x 10-2 mol/L et le titre massique est de 1,9%. Ces résultats correspondent aux informations données dans l'énoncé.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Le colorant E127 (2)
Bonjour à tous, aujourd'hui je vais vous résumer la deuxième partie de cet exercice sur le colorant E-127. Dans cette partie, nous allons effectuer une synthèse organique de la molécule d'érythrosine à partir de la fluorescine. Nous avons décrit les différentes étapes de la synthèse et nous devons maintenant identifier le rôle des étapes numéro 1 et numéro 2 du protocole expérimental. L'étape numéro 1 consiste à réaliser la réaction chimique de synthèse proprement dite, tandis que l'étape numéro 2 consiste à filtrer le mélange réactionnel et à laver le solide obtenu. Ensuite, nous devons expliquer comment la température de fusion du solide obtenu est utilisée pour caractériser le produit de la synthèse. En mesurant la température de fusion et en obtenant la même valeur que celle du produit recherché, nous pouvons conclure que la synthèse a réussi. Ensuite, nous devons identifier l'opération réalisée dans le protocole expérimental pour optimiser la vitesse de formation. Dans ce cas, il s'agit du chauffage à reflux, qui permet d'accélérer la réaction. Ensuite, nous devons déterminer le réactif limitant dans la synthèse de l'érythrosine. En utilisant un tableau d'avancement, nous pouvons déterminer que le réactif limitant est I2. Ensuite, nous devons montrer que la masse formée est d'environ 4,6 grammes. Pour cela, nous utilisons le rendement de la réaction et les quantités de matière initiales pour calculer la masse théorique. Finalement, nous devons déterminer le nombre de flacons de 10 millilitres, de pH égal à 7 et d'une certaine concentration, qui peuvent être fabriqués avec cette synthèse. En convertissant la masse expérimentale en quantité de matière, puis en utilisant la concentration et le volume des flacons, nous trouvons qu'il est possible de fabriquer 25 flacons. Voilà pour le résumé de cette deuxième partie de l'exercice.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Le colorant E127 (3)
Le cours porte sur la décoloration du colorant E127 en utilisant de l'eau de Javel. Deux expériences sont réalisées, l'une avec de l'eau de Javel diluée et l'autre avec de l'eau de Javel pure. On étudie l'évolution de la concentration du colorant au cours du temps.
Dans la première partie, on décrit qualitativement l'évolution de la vitesse volumique de disparition du colorant. On explique que la vitesse est représentée par la pente de la courbe de concentration en fonction du temps, et que cette pente est négative car la concentration diminue.
Ensuite, on propose un facteur cinétique qui peut expliquer la diminution de la vitesse au cours du temps, qui est la diminution de la concentration en réactif. On mentionne que ce facteur cinétique peut être une bonne explication même si on n'est pas sûr à cent pourcent.
Dans la deuxième partie, on détermine graphiquement le temps de demi-réaction pour l'expérience A, en cherchant le temps nécessaire pour atteindre la moitié de la concentration initiale. On trouve que cela prend environ 150 secondes. On explique que le temps de demi-réaction permet d'estimer quand la réaction est terminée, et qu'au bout de 5 fois le temps de demi-réaction, la réaction est complète.
Enfin, on discute de l'optimisation de la décoloration du filtre Buchner. On explique que l'objectif est d'augmenter la vitesse de réaction. En comparant les deux expériences, on remarque que l'expérience avec de l'eau de Javel pure est presque deux fois plus rapide que l'expérience avec de l'eau de Javel diluée. On conclut donc que pour optimiser la décoloration, il est préférable d'utiliser de l'eau de Javel pure.
En résumé, le cours concerne la décoloration du colorant E127 avec de l'eau de Javel. On analyse l'évolution de la concentration du colorant au cours du temps, on propose des explications pour la diminution de la vitesse de disparition du colorant, on détermine graphiquement le temps de demi-réaction et enfin on discute de l'optimisation de la décoloration en utilisant de l'eau de Javel pure.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

La physique du jonglage
Aucun résumé n'est disponible pour cette vidéo
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Refroidissement d’un fer à cheval
Le cours porte sur le refroidissement d'un fer à cheval. Il comprend deux parties : le chauffage du fer et le refroidissement du fer.
Dans la première partie, on détermine la masse du fer à cheval en utilisant la masse volumique du fer. Ensuite, on calcule la variation d'énergie interne du fer lors du chauffage. On interprète cette variation comme une augmentation de l'énergie cinétique microscopique des atomes de fer.
Dans la deuxième partie, on étudie le refroidissement du fer à l'air libre et dans l'eau. On utilise le premier principe de la thermodynamique pour obtenir une équation différentielle qui régit l'évolution de la température lors des pertes thermiques. On vérifie si une fonction proposée est solution de cette équation. On calcule ensuite la valeur de la température du fer lorsqu'il est posé sur la face intérieure. Enfin, on analyse les résultats et on propose des raisons pour lesquelles le modèle utilisé pour le refroidissement dans l'eau ne semble pas cohérent, en citant notamment les pertes de chaleur par rayonnement et les variations de température de l'eau.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Défibrilateur cardiaque
Le sujet de cet exercice C porte sur l'étude d'un défibrillateur cardiaque, qui est un circuit RC. Dans un premier temps, il est demandé de déterminer dans quelle position mettre l'interrupteur pour charger le condensateur. Il faut que l'interrupteur soit en position 1 pour que le générateur et le condensateur soient dans la même boucle. Ensuite, il faut trouver l'équation différentielle du circuit en utilisant la loi des mailles et les lois de fonctionnement de chaque dipôle. En résolvant l'équation, on obtient l'expression recherchée. Il faut ensuite vérifier que la solution est sous la forme demandée. On calcule également le taux de charge du condensateur, qui correspond à la constante de temps du circuit. Il est également demandé de tracer la courbe de l'évolution temporelle de la tension. On montre que le condensateur atteint 99% de sa valeur finale au bout de 5 taux de charge. Ensuite, on s'intéresse à la décharge du condensateur. On détermine graphiquement l'instant où l'interrupteur bascule de la position 1 à la position 2. On trace également la tangente à l'origine pour déterminer le temps caractéristique de décharge. On estime ensuite la durée nécessaire de décharge du condensateur en fonction de la résistance du corps humain. On conclut en montrant que la décharge est inférieure aux 4 secondes prévues pour le choc et que le choc dure donc moins d'une seconde.


