 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Modélisation des réactions acide-base
- Analyse physique d'un système chimique
- Méthode de suivi d'un titrage
- Evolution temporelle d'une transformation chimique
- Evolution temporelle d'une transformation nucléaire
- Evolution spontanée d'un système chimique
- Equilibre acide-base
- Transformations chimiques forcées
- Structure et organisation en chimie organique
- Stratégies de synthèses
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Modélisation des réactions acide-base
- Analyse physique d'un système chimique
- Méthode de suivi d'un titrage
- Evolution temporelle d'une transformation chimique
- Evolution temporelle d'une transformation nucléaire
- Evolution spontanée d'un système chimique
- Equilibre acide-base
- Transformations chimiques forcées
- Structure et organisation en chimie organique
- Stratégies de synthèses
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
Terminale

Quantité d’électrons
Dans cette vidéo, nous allons étudier les quantités d'électrons échangés lors d'une réaction électrochimique. La demi-équation électrochimique à la cathode d'un électrolyseur est Al3+ + 3 électrons → Al solide. Nous devons donc écrire la quantité d'électrons transférés, Ne, en fonction de la quantité de matière d'aluminium formée. C'est une question importante en électrochimie, car le courant dépend de ces quantités.
Pour cela, nous pouvons raisonner avec des phrases. Pour chaque atome d'aluminium formé, il y a 3 électrons consommés. Ainsi, la quantité d'électrons consommée est égale à 3 fois la quantité d'aluminium formé. Par exemple, si une mole d'aluminium est formée, 3 moles d'électrons sont consommées.
Ce raisonnement est essentiel à comprendre et nous permettra de résoudre différents exercices. Il est donc utile de se rappeler qu'il est pratique de raisonner avec des phrases. Merci de suivre cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Équation de réaction
Dans cette vidéo, Mathis explique comment écrire une équation de réaction en électrochimie. Il mentionne que lors d'une électrolyse, les réactions électrochimiques aux électrodes sont les suivantes : le nickel solide donne Ni²+ et deux électrons, et le Zn²+ donne Zn solide et deux électrons. Pour écrire l'équation de la réaction d'électrolyse, il faut combiner linéairement les équations de manière à égaler le nombre d'électrons de part et d'autre. On souhaite que dans l'équation finale, il n'y ait pas d'électrons qui interviennent. En sommant les deux équations, on obtient deux électrons de chaque côté, ce qui permet de les supprimer. L'équation finale est donc Ni solide plus Zn²+ est égal à Ni²+ plus Zn solide. Cette équation est parfaitement équilibrée. Peu importe la manière dont on combine linéairement les équations, on obtiendra toujours une équation équilibrée qui décrit la réalité chimique de ce qui se passe dans la pile. Il est important de comprendre qu'il faut combiner linéairement les différentes équations pour compenser le nombre d'électrons produits ou consommés de chaque côté.
Physique-Chimie
Chimie
Terminale

Raisonnement inverse
Dans cette vidéo, on aborde la réaction d'électrolyse d'une solution de chlorure de fer 3 : 2Cl- + 2Fe3+ + eau -> Cl2 + 2Fe2+ + eau. Pour écrire les demi-équations électrochimiques et les couples d'oxydoréduction, on introduit artificiellement un nombre d'électrons. On remarque que la charge varie de 2 lorsqu'on passe d'une espèce à l'autre. Ainsi, on introduit 2 électrons de chaque côté pour équilibrer la charge. On sépare ensuite les deux équations : 2Cl- -> Cl2 + 2e- et 2Fe3+ + 2e- -> 2Fe2+. Simplifiées, les équations deviennent Fe3+ + e- -> Fe2+ et Cl2 + 2e- -> 2Cl-.
Les couples d'oxydoréduction associés sont Fe3+/Fe2+ et Cl2/Cl-. Cette approche inversée de l'électrolyse permet de mieux comprendre les phénomènes chimiques impliqués. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Spontannée ou forcée ?
Dans cette vidéo, Mathis explique comment déterminer si une réaction chimique évolue de manière spontanée ou forcée. Il présente une équation chimique formelle impliquant A, Aq, Bq, CAq et D. La constante d'équilibre à 25°C est de 2,8x10^4 et le quotient de réaction initiale est de 10. Pour déterminer le sens d'évolution de la réaction, il compare le quotient de réaction avec la constante d'équilibre. Si le quotient de réaction est inférieur à la constante d'équilibre, la réaction évolue dans le sens direct, où A et B sont des réactifs pour former C et D. Si le quotient de réaction est supérieur à la constante d'équilibre, la réaction évolue dans le sens inverse, où C et D réagissent pour former A et B. Il est également possible de forcer la réaction à évoluer dans le sens inverse en apportant de l'énergie, comme dans le cas des batteries rechargeables. Cependant, cela nécessite un apport d'énergie, souvent sous forme électrique.
Physique-Chimie
Chimie
Terminale
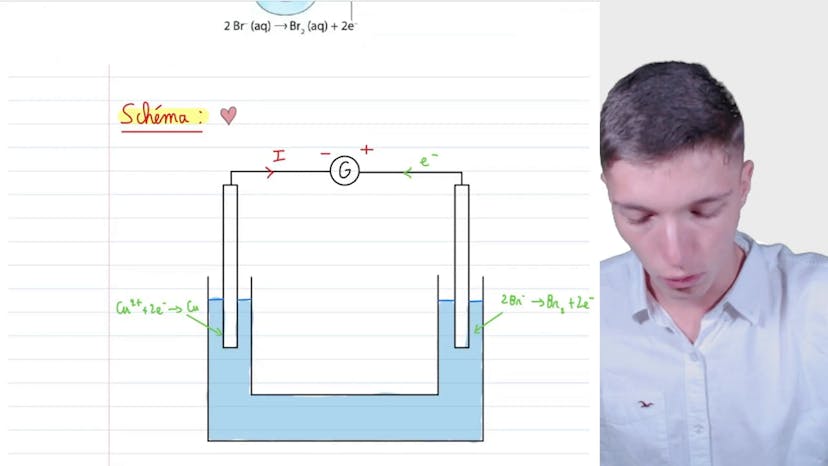
Schéma d’électrolyse
Dans cette vidéo, nous apprenons le schéma classique d'un électrolyseur pour la solution de bromure de cuivre 2. Nous devons recopier et compléter le dispositif relatif à l'électrolyse, en précisant les branchements du générateur, le sens conventionnel du courant et le sens de déplacement des électrons. Les deux électrodes du dispositif sont présentées, avec les réactions qui se produisent à chaque électrode. Le sens de déplacement des électrons peut être déterminé en observant si les électrons sont consommés ou produits à chaque électrode. Dans le cas présent, les électrons sont émis au niveau de l'électrode de gauche et consommés à l'électrode de droite. Le sens de déplacement du courant est donc inverse à celui des électrons. Les branchements du générateur sont indiqués, avec le courant se déplaçant du plus vers le moins. En suivant cette méthodologie, un schéma clair et compréhensif peut être construit pour l'examinateur ou pour le bac. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
Dépôt de cuivre
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
Terminale

Dépôt d’argent
Dans cette vidéo, l'auteur explique le processus d'un dépôt d'argent sur une statuette métallique à l'aide d'un électrolyseur. Les réactions se produisant à chaque électrode sont les suivantes:
- À l'électrode en argent: Ag+ + e- -> Ag (oxydation de l'ion argent en argent solide)
- À l'électrode en graphique: 2H2O -> O2 + 4H+ + 4e- (oxydation de l'eau en dioxygène)
L'équation de la réaction d'électrolyse est obtenue en combinant linéairement les demi-équations. Dans ce cas, elle est donnée par:
4Ag+ + 2H2O -> 4Ag + O2 + 4H+
Ensuite, l'auteur aborde la quantité d'électricité Q qui a traversé l'électrolyseur pendant une durée de 15 minutes, avec une intensité du courant constante à 80 mA. Il explique qu'il y a deux façons d'exprimer la charge débitée par une pile: la vision chimique, où la charge est égale au nombre de molles d'électrons échangés multiplié par le faraday (F), et la vision électrique, où la charge est égale à l'intensité du courant multipliée par la durée d'électrolyse. Dans ce cas, la charge est de 72 coulombs.
Ensuite, l'auteur répond à la question sur la quantité de matière d'argent déposée sur la statuette. Il explique qu'il faut relier le nombre de molles d'électrons échangés au nombre de molles d'argent. Il utilise la relation Q = nE * F, où nE est le nombre de molles d'électrons échangés, E est la charge d'une molle d'électrons et F est le nombre d'Avogadro. Il conclut que le nombre de molles d'argent déposé est de 7,5 x 10^-4 molles, ce qui correspond à une masse de 80 mg en multipliant par la masse molaire.
Enfin, l'auteur aborde la question du volume de gaz formé, en particulier le dioxygène. Il explique que le nombre de molles d'électrons échangés peut être lié au nombre de molles de dioxygène formé. Il utilise la relation nO2 = nE / 4, où nO2 est le nombre de molles de dioxygène formé. En considérant le dioxygène comme un gaz parfait, il peut relier le nombre de molles d'O2 au volume du gaz en utilisant la relation V = nO2 * R * T / P, où V est le volume, R est la constante des gaz parfaits, T est la température et P est la pression. Il conclut que le volume de dioxygène formé est de 4,6 mL pour une pression de 1 bar et une température de 298 K.
En résumé, cette vidéo explique le processus d'un dépôt d'argent sur une statuette métallique à travers l'utilisation d'un électrolyseur. Elle aborde les réactions électrochimiques qui se produisent à chaque électrode, la quantité d'électricité traversant l'électrolyseur, la quantité de matière d'argent déposée et le volume de gaz formé.
Physique-Chimie
Chimie
Terminale

Eau de Javel
Dans cette vidéo, on aborde la fabrication de l'eau de Javel, en particulier la production de l'ion hypochlorite Cl-. Cette fabrication se fait par électrolyse d'une solution aqueuse de chlorure de sodium Na+ Cl-. Les électrodes utilisées sont en graphite inerte. Sur l'anode, du dichlore gazeux (Cl2) se forme, tandis que sur la cathode, de l'eau (H2O) réagit pour produire du dihydrogène (H2).
Pour la première question, on doit écrire la demi-équation de la réaction sur l'anode et en déduire l'équation de la réaction d'électrolyse. La demi-équation sur l'anode est : 2Cl- = Cl2 + 2e-. En sommant cette équation avec celle sur la cathode, qui est donnée, on obtient l'équation d'électrolyse : 2H2O + 2Cl- = Cl2 + H2 + 2OH-.
Pour la deuxième question, il faut faire un schéma du montage en précisant le sens de circulation des porteurs de charge. L'anode est à droite et la cathode est à gauche. À l'anode, l'oxydation se produit, avec la libération de Cl2 gazeux. À la cathode, la réduction se produit, avec la formation de H2 gazeux. Les électrons sont libérés à l'anode et consommés à la cathode. Ainsi, le sens de déplacement des électrons est de la droite vers la gauche, et le sens de déplacement du courant est inversé, de la gauche vers la droite.
Enfin, pour la troisième question, on nous demande d'écrire l'équation d'oxydoréduction correspondant à la réaction du dichlore avec lui-même. On équilibre les demi-équations des deux couples redox (Cl2/Cl- et Cl-/Cl2) et on les combine. On obtient donc l'équation bilan : 2Cl2 + 2H2O = 2Cl- + 2Cl- + 4H+. Cette réaction montre comment le dichlore agit à la fois comme oxydant et comme réducteur sur lui-même.
En résumé, cette vidéo explique le processus de fabrication de l'eau de Javel par électrolyse d'une solution de chlorure de sodium. Les différentes réactions, les équations et le schéma du montage sont détaillés.
Révisions Physique Lycée
Chimie
MPSI/PCSI
Quantité d’électrons
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Équation de réaction
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Raisonnement inverse
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Spontannée ou forcée ?
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Schéma d’électrolyse
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Dépôt de cuivre
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Dépôt d’argent
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Eau de Javel
Aucun résumé n'est disponible pour cette vidéo


