 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
Terminale

Acide nitrique
Dans cette vidéo, Mathis de Studio aborde le sujet des équilibres acide-base en commençant par l'acide nitrique. L'acide nitrique (HNO3) est considéré comme un acide fort, ce qui signifie qu'il se dissocie complètement dans l'eau. L'équation de sa réaction avec l'eau peut donc être écrite avec une flèche directe.
Dans une réaction acide-base, l'acide donne sa base conjuguée et la base donne son acide conjugué. Ainsi, l'acide nitrique donne sa base conjuguée NO3-, en enlevant un proton H+ de la molécule. De son côté, l'eau joue le rôle de base dans cette réaction, et son acide conjugué est HO+.
L'équation de réaction s'écrit donc : HNO3 + H2O → NO3- + H3O+. Cette équation permet d'écrire la dissolution d'un acide dans de l'eau. Il est important d'adapter cette équation en fonction de l'acide considéré, mais cela permet d'identifier de nombreuses équations.
Merci d'avoir regardé cette courte vidéo et à bientôt.
Physique-Chimie
Chimie
Terminale

Ion hydrogénophosphate
Dans cette vidéo, Mathis du Studio aborde l'ion hydrogénophosphate, HPO4²-. Il explique que l'ion hydrogénophosphate est une base faible et qu'on nous demande d'écrire son équation de réaction avec l'eau. Une base faible ne réagit pas totalement avec l'eau, ce qui nous donne des indices sur le formalisme de la réaction.
Ensuite, Mathis identifie les espèces qui réagissent entre elles pour former les produits. Comme il s'agit d'une réaction acide-base, la base faible HPO4²- réagit avec l'eau pour former son acide conjugué H2PO4-, tandis que l'eau agit en tant qu'acide pour réagir et former sa base conjuguée H²-.
L'équation de réaction est donc la suivante : HPO4²-Aqe + H2O liquide ⇌ H2PO4-Aqe + HO-Aqe. La double flèche indique que la réaction n'est pas totale en raison de la nature de la base faible. Si la réaction était totale, une simple flèche serait utilisée pour indiquer le sens réactif vers produit.
L'équation est équilibrée, ce qui est normal et ne pose aucun problème.
En résumé, cette vidéo explique comment établir une équation acide-base en fonction de la nature du composé de départ et comment identifier les différentes espèces impliquées dans la réaction.
Physique-Chimie
Chimie
Terminale
Couples de la glycine
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
Terminale
Constante d’acidité
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
Terminale

Produit ionique
Dans cette vidéo, Matisse de Studio explique le concept du produit ionique de l'eau. Le produit ionique de l'eau, noté Ke, est la constante d'équilibre de la réaction d'autoprotolyse de l'eau. Cette réaction se produit lorsque deux molécules d'eau réagissent ensemble pour former à la fois un acide, H3O+, et une base, OH-.
L'expression du produit ionique de l'eau est Ke = [H3O+][OH-], où [H3O+] représente la concentration en ions oxonium et [OH-] représente la concentration en ions hydroxyde.
Dans les solutions aqueuses, les ions oxonium et les ions hydroxyde sont toujours en équilibre, et leur concentration est liée par cette équation. La valeur de Ke est toujours égale à 10-14.
Dans cet exercice, on nous donne la concentration en ions hydroxyde, qui est de 3,2x10-6 mol/l. On peut utiliser cette valeur pour calculer la concentration en ions oxonium en utilisant l'expression Ke = [H3O+][OH-].
En divisant Ke par la concentration en ions hydroxyde, on obtient la concentration en ions oxonium, qui est de 3,1x10-9 mol/l.
En utilisant la formule du pH, pH = -log[H3O+], on peut calculer le pH de la solution, qui est de 8,5.
En résumé, le produit ionique de l'eau lie les concentrations en ions oxonium et en ions hydroxyde dans les solutions aqueuses. Il permet de calculer le pH d'une solution à partir des concentrations en ions oxonium ou en ions hydroxyde.
Physique-Chimie
Chimie
Terminale

Acide lactique
Dans cette vidéo, il est expliqué que l'acide lactique réagit avec l'eau pour former sa base conjuguée CH3H5O3- en solution aqueuse. En même temps, l'eau agit comme une base et réagit avec l'acide pour former son acide conjugué H3O+. La constante d'acidité Ka associée à cette réaction est exprimée comme la concentration en CH3H5O3- multipliée par la concentration en H3O+, divisée par la concentration en acide lactique. En utilisant la concentration en H3O+ donnée (2,5 millimoles par litre) et le pKa du couple acide lactique (3,9), on peut calculer la concentration en acide lactique à l'équilibre (5.10^-2 mol par litre). Cette constante d'acidité permet de calculer rapidement des concentrations d'espèces inconnues en utilisant des valeurs connues de concentrations d'acide et de base.
Physique-Chimie
Chimie
Terminale
Indicateur coloré
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
Terminale

pH et pKa
Dans cette vidéo, Mathis du studio nous explique les relations entre le pH et le pKa en se concentrant sur l'acide lactique. L'acide lactique se trouve dans le lait, le vin et certains fruits et légumes. Mathis utilise un diagramme de prédominance pour montrer les proportions de AH (l'acide lactique) et A- (ion lactate) en fonction du pH. Il explique que pour déterminer le pH où la concentration en A- est égale à celle de AH, il suffit de trouver l'intersection entre les deux courbes, qui dans ce cas est pH1 = 4. Ensuite, pour trouver le pKa correspondant, il utilise une formule où le pH est égal à pKa plus le log de la concentration en base divisée par la concentration en AH. En utilisant cette formule, il détermine que pKa = 4. Ensuite, il utilise le diagramme de prédominance pour déterminer les proportions d'acide et de base lorsque le pH = 3, soit environ 10% pour A- et 90% pour AH. Enfin, il utilise une autre méthode en utilisant la formule précédente avec les nouvelles valeurs de proportion pour trouver pKa, qui est encore égal à 4. Il souligne que le pKa est une constante qui reste la même quelles que soient les concentrations et les valeurs de pH. Il conclut en disant que comprendre le lien entre le pH et le pKa est crucial pour résoudre de nombreux exercices en chimie.
Physique-Chimie
Chimie
Terminale
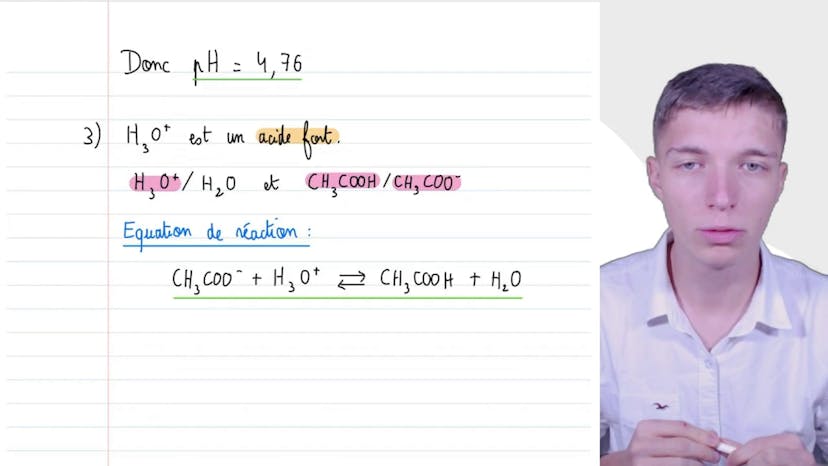
Calculs de pH
Dans cette vidéo, Mathis explique l'évolution du pH en fonction de différentes réactions. Il commence par calculer le pH d'une solution d'acide fort (HCl), en utilisant un tableau d'avancement. Il obtient un pH de 3.
Ensuite, il étudie une solution tampon préparée avec de l'acide éthanoïque (CH3COOH) et de l'éthanoate de sodium (CH3CONA), en utilisant la formule du pH liée au pKa d'un couple acide-base. Il conclut que le pH de la solution tampon est égal au pKa de ce couple, soit 4,76.
Enfin, il analyse l'effet de l'ajout d'ions oxonium (H3O+) sur le pH de la solution tampon. Il écrit l'équation de la réaction acide-base entre les ions oxonium et les ions éthanoate, et utilise à nouveau la formule du pH liée au pKa pour calculer le pH final de la solution tampon, en prenant en compte les différentes concentrations des espèces du couple acide-base. Il obtient un pH final de 4,67.
En résumé, Mathis explique comment calculer le pH d'une solution en utilisant soit la concentration en ions oxonium, soit les concentrations des espèces d'un même couple acide-base. Il souligne également l'impact de l'ajout d'ions auxonium sur l'acidification de la solution.
Physique-Chimie
Chimie
Terminale

Hydrogénosulfate de sodium
Dans cette vidéo, Mathias de Studio explique l'hydrogénosulfate de sodium. Il indique que l'objectif de l'exercice est d'écrire l'équation de dissolution de l'hydrogénosulfate de sodium dans l'eau, l'équation de réaction acide-base de l'ion hydrogénosulfate avec l'eau, et d'exprimer la constante d'acidité du couple acide-base. Il explique également qu'il faut déduire les valeurs des concentrations des espèces chimiques présentes en solution et calculer la constante d'acidité, en se basant sur le pH de la solution qui est de 2,2. Pour résoudre l'exercice, il utilise un tableau d'avancement et détermine les concentrations finales des différentes espèces chimiques en solution. Il conclut en calculant la constante d'acidité (Ka) et en déduisant le pKa. Il souligne l'importance de savoir déterminer l'état d'un système et de comprendre quelles concentrations vont varier, tout en évitant d'oublier les ions spectateurs.
Physique-Chimie
Chimie
Terminale
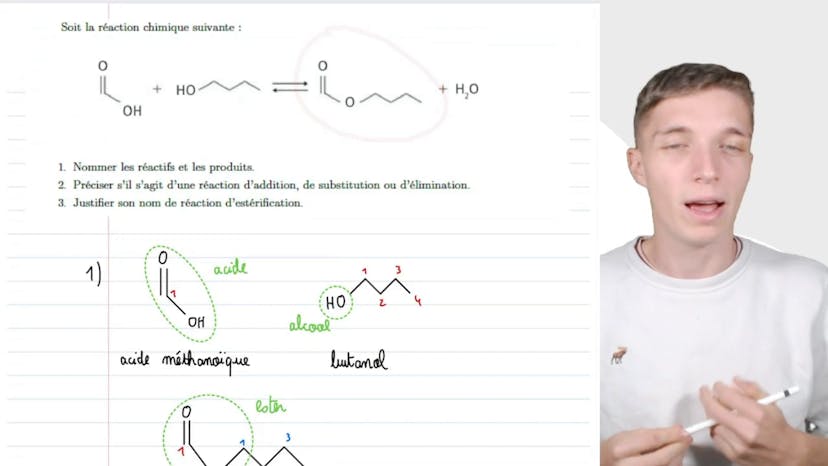
Estérification
Dans cette vidéo, Mathis du studio aborde les stratégies de synthèse, en particulier la réaction d'estérification en chimie organique. Il explique que cette réaction est très importante et intéressante pour les étudiants en prépa. Il commence par nommer les réactifs et les produits de la réaction. Il utilise la méthode de la chaîne carbonée principale et des fonctions pour nommer les molécules. Il explique également que la réaction d'estérification consiste à former un estère à partir d'un acide carboxylique. Il précise que c'est une réaction de substitution car un groupement OH est remplacé par un autre groupement. Enfin, il justifie le nom de la réaction en expliquant qu'elle consiste à former un estère à partir d'un acide carboxylique, d'où le terme "esterification". Il conclut en soulignant l'importance de connaître les mécanismes réactionnels en chimie organique.
Physique-Chimie
Chimie
Terminale

Types de modification
Dans cette vidéo, on aborde les différents types de modifications en chimie organique. On analyse une réaction complexe où une molécule linéaire s'additionne sur elle-même pour former une molécule cyclique. Nous devons identifier les modifications de groupe, de chaîne et de polymérisation. Nous observons ici une formation de cycle, ce qui indique une modification de chaîne carbonée. De plus, les groupements carboxyles sont transformés en groupements carbonyles, ce qui représente une modification de groupe. Il n'y a pas de polymérisation car il n'y a pas d'enchaînement répété de motifs moléculaires. Cette réaction est très importante dans l'enseignement supérieur et il est essentiel de pouvoir analyser les modifications présentes. Merci d'avoir suivi cette vidéo et à bientôt !


