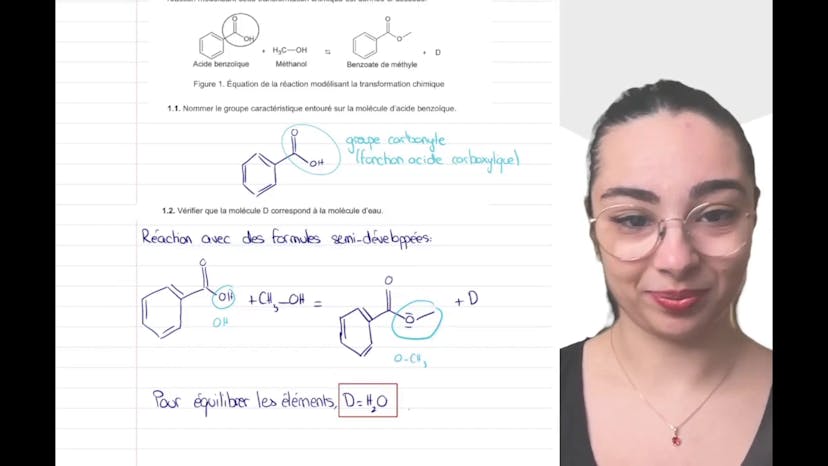
All subjects
All subjects
 All subjects
All subjects
Synthèse d’un ester à odeur florale (4)
Bonjour à tous, ici Leïla de Studio. Aujourd'hui, nous allons continuer notre exercice de synthèse d'un ester qui a été réalisé l'année dernière lors de Pâques. Pour récapituler les parties précédentes, nous avons déjà identifié les différentes étapes de la synthèse, justifié le protocole et abordé les considérations expérimentales. Dans la partie 3, nous avons identifié le produit de notre synthèse à l'aide d'un spectre infrarouge. Maintenant, nous allons nous intéresser aux questions de rendement.
Il est important de savoir non seulement quel produit nous avons fabriqué, mais aussi dans quelle quantité cela a été fait, pour que cela soit intéressant pour nous. Nous disposons des masses molaires nécessaires, nous rappelons la réaction chimique et à l'aide des données de l'étape 1 du protocole de synthèse, nous devons déterminer les quantités de réactif, appelées NAlcool et NAcide, utilisées dans la réaction.
Pour cela, nous devons utiliser les formules de conversion entre les masses et les masses molaires. Personnellement, je n'ai pas toutes ces formules en tête, mais j'utilise une approche basée sur l'analyse dimensionnelle pour vérifier leur validité. En utilisant les données dont nous disposons, nous pouvons dire que la quantité initiale d'alcool est de 99 millimoles. Soyez attentifs aux conversions entre les masses et les masses molaires, car c'est souvent là que se trouve le piège dans les exercices numériques. Il est important de vérifier que tout est cohérent.
Nous utilisons la même méthode pour l'acide. Donc ici, cela sera MAcide / MAcide, et nous obtenons 100 millimoles. Nous en déduisons ensuite que les réactifs ont été introduits dans des proportions stœchiométriques. Cela signifie que ces réactifs disparaissent à la même vitesse dans le tableau d'avancement. Ce terme signifie simplement que la quantité divisée par le coefficient stœchiométrique est la même. Pour résumer, nous avons trouvé que la quantité initiale d'alcool était d'environ 99 millimoles et la quantité initiale d'acide était d'environ 100 millimoles.
Ensuite, on nous demande de compléter le tableau d'avancement. Ce tableau présente les états initial, intermédiaire et final de la réaction. Nous avons donc deux ou trois lignes, selon la configuration. Dans l'état initial, nous énumérons les réactifs introduits, c'est-à-dire l'acide et l'alcool, et rien d'autre. Dans l'état intermédiaire, nous notons les réactifs consommés en soustrayant X, où X est l'avancement de la réaction. Nous notons également les produits formés, c'est-à-dire l'eau et l'ester, avec X comme coefficient. Pour l'état final, nous remplaçons X par XF, qui est notre avancement final. Le tableau d'avancement est un outil essentiel pour suivre l'évolution d'une réaction.
Ensuite, nous devons déterminer les quantités de matière de toutes les espèces présentes à l'état final, qui sont notées NAcide-X, NAlcool-X et NEster-X. Nous avons déjà calculé la quantité d'ester expérimentale, qui est de 9,11 grammes, ce qui correspond à environ 67 millimoles. Nous savons également que la quantité d'eau formée est similaire à celle de l'ester, soit 67 millimoles. Cette information, associée au tableau d'avancement, nous permet de déterminer les quantités restantes des réactifs, qui sont environ 33 millimoles pour l'acide et 32 millimoles pour l'alcool.
Ensuite, nous devons montrer que le rendement de la synthèse approche les 67%. Le rendement est le rapport entre la quantité obtenue et la quantité maximale théorique. Dans ce cas, nous avons calculé que nous avons obtenu 67 millimoles d'ester et la quantité maximale théorique est de 100 millimoles. Par conséquent, le rendement est d'environ 67%.
Enfin, nous devons proposer une méthode pour améliorer le rendement de la synthèse. Dans l'idéal, nous voudrions atteindre un rendement de 100%. Pour cela, nous devons examiner le coefficient de la réaction, Ka. Nous pouvons augmenter les quantités de réactifs en excès et réduire la quantité d'eau formée, car elle perturbe l'équilibre de la réaction en limitant la formation de l'ester. Une méthode efficace pour éliminer l'eau au fur et à mesure de la réaction est le procédé Dean-Stark.
J'espère que cette synthèse du cours vous a été utile. N'hésitez pas à poser vos questions dans les commentaires. À bientôt pour la partie finale de cet exercice.