 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
Terminale

Lutte contre le varroa
L'acide formique HCOH est utile pour lutter contre le varroa, un acarien destructeur de colonies d'abeilles. Il est sécrété par des fourmis et certaines plantes. Pour préparer un traitement à l'acide formique à 60%, il faut diluer une solution à 80%. Pour ce faire, l'apiculteur doit verser 18 litres de la solution à 80% dans un bidon, compléter avec 6 litres d'eau, pour obtenir une concentration à 60%. Avec 24 litres de traitement ainsi préparé, il pourra traiter ses 150 colonies avec les quatre traitements successifs de 40ml nécessaires à chaque colonie. L'exercice est un cas typique où une analyse minutieuse du problème est nécessaire pour proposer une stratégie efficace.
Physique-Chimie
Chimie
Terminale

Titrage des ions chlorure
Bonjour à tous, dans cette vidéo, nous allons parler du titrage de l'eau de mer pour déterminer sa concentration en ion chlorure. Pour cela, nous utilisons une solution de nitrate d'argent Ag+, NO3- de concentration C2=10^-1 mol/L que nous ajoutons à un volume de 10 mL d'eau de mer diluée 10 fois. La réaction support du dosage est une réaction de précipitation qui forme du chlorure d'argent AgCl. Avant de commencer le dosage, nous ajoutons 200 mL d'eau.
La première question consiste à schématiser le montage. Nous avons une cellule conductimétrique reliée à un conductimètre. Dans la burette graduée, nous avons la solution titrante de Ag+, NO3- de concentration C2. Dans le bécher, nous avons la solution titrée d'ions Na+, Cl- de concentration C1, avec l'ajout de 200 mL d'eau.
La deuxième question demande d'écrire l'équation de la réaction support du dosage, qui est Ag+(aq) + Cl-(aq) donnant AgCl(s).
Le volume à l'équivalence est donné par CvE=15,2 mL. A partir de cela, nous pouvons déduire la concentration en ion chlorure de l'eau de mer. En équilibrant les quantités de matière, nous avons que la quantité de matière d'Ag+ introduite est égale à la quantité de matière de Cl- initialement présente dans le bécher. La quantité de matière de Cl- dans le bécher est donnée par C1V, où V est le volume de l'eau de mer diluée (10 mL). Donc, C1V = C2VE, où VE est le volume versé jusqu'à l'équivalence. Finalement, en effectuant l'application numérique, nous obtenons que C1=1,5*10^-1 mol/L. Mais il faut noter que l'énoncé indique que l'eau de mer a été diluée 10 fois. Donc, la concentration en ion chlorure de l'eau de mer est de 1,5 mol/L.
Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
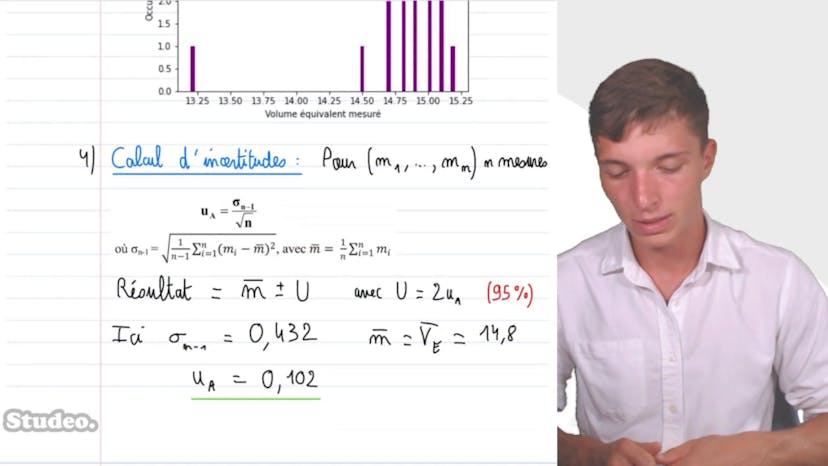
Comparaison de résultats
Matisse de Studio compare les résultats de mesure d'un titrage pour déterminer la concentration de l'ammoniaque dans une solution. Le titrage est réalisé en dosant un volume de 5 millilitres d'ammoniaque de concentration C1 inconnue avec de l'acide chlorhydrique de concentration C2. Les volumes équivalents obtenus par les élèves sont regroupés dans un tableau.
Le schéma du montage montre la solution titrante dans une burette graduée et la solution titrée dans un bécher. L'équation de la réaction support du dosage est NH3 + H3O+ → NH4+ + H2O.
La série de mesures est représentée sous forme d'un histogramme dans un tableur. Chaque bâtonnet représente une valeur mesurée et son occurrence.
L'incertitude type sur le volume à l'équivalence est évaluée par une approche statistique. Elle est calculée à partir de l'écart type de la série statistique et de la taille de l'échantillon. L'incertitude élargie correspond à 2 fois l'incertitude type, à 95% de confiance.
La valeur de la concentration en ammoniaque de la solution est exprimée avec son incertitude en utilisant l'équation de titrage. La quantité de matière de NH3 est égale à la quantité de HO- versée, ce qui permet de calculer la concentration C1.
Physique-Chimie
Chimie
Terminale
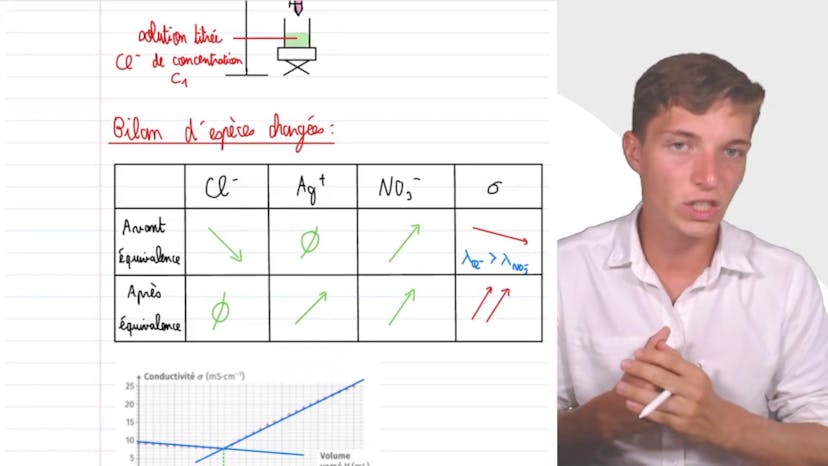
Dosage des ions dans une eau de brassage
Dans cette vidéo, Mathis de Studio étudie l'exercice de contrôle qualité visant à déterminer si une eau de brassage convient pour la fabrication d'une bière brune. Pour ce faire, un titrage conductimétrique est utilisé pour déterminer la concentration en ions Cl- de l'eau considérée. En analysant la courbe conductimétrique, on peut déterminer le volume équivalent et la concentration en mol par litre. En convertissant la concentration en mg par litre, on découvre que la concentration de l'eau de brassage n'est pas suffisante pour fabriquer de la bière brune conformément à la réglementation.
Physique-Chimie
Chimie
Terminale

Conservation des foins
Dans cette vidéo, un agriculteur demande de l'aide pour conserver ses foins. Pour éviter les moisissures, il utilise un traitement à base d'acide propionique. Cet acide bloque le développement des bactéries, levures et moisissures, permettant de conserver les foins au sec. La fiche technique du produit indique qu'il contient 73% d'acide propionique, 2% d'eau et 21% de propionate d'ammonium. La densité du bidon est de 0,99. La problématique consiste à calculer la concentration en acide propionique de la solution utilisée pour le séchage des foins. Cela se fait en divisant la quantité de matière d'acide par le volume de la solution. En utilisant les informations fournies, on trouve que la masse d'acide dans le bidon est de 14,6 kg, ce qui correspond à 1,97x10^2 mol d'acide. Pour déterminer le volume de la solution, on utilise la densité qui est de 990 kg/m^3. En isolant le volume, on trouve qu'il est de 20,2 litres. Ainsi, la concentration en acide propionique de la solution utilisée est de 9,75 mol/l. Il est important de bien comprendre la question posée avant de commencer les calculs.
Physique-Chimie
Chimie
Terminale

Titrage d'un détartrant pour cafetière
Dans cette vidéo, on nous présente l'acide sulfamique, un détartrant utilisé pour les cafetières. On prépare une solution en versant 1 g d'acide sulfamique dans une fiole jaugée de 100 ml et en complétant avec de l'eau distillée. On dose ensuite 20 ml de cette solution avec de la soude de concentration 0,1 mol/l. On trace ensuite la courbe pH-volume de la soude versée pour déterminer la pureté de la poudre contenue dans le sachet de détartrant. Pour cela, on pose des grandeurs arbitraires : MA (masse d'acide sulfamique dans le sachet) et CA (concentration d'acide sulfamique dans la solution). On utilise la réaction acide-base entre l'acide sulfamique et l'ion hydroxyle pour déterminer CA en utilisant la quantité de matière de l'acide A égale à la quantité de matière de HO-. On fait attention au volume que l'on titre (20 ml) et on utilise la méthode des tangentes pour déterminer VE (volume équivalent). On en déduit que CA est égal à 0,103 mol/l. En utilisant cette relation, on peut isoler MA (masse d'acide sulfamique) et on obtient 1 g, ce qui nous permet de conclure que le sachet est bien pur.
Physique-Chimie
Chimie
Terminale
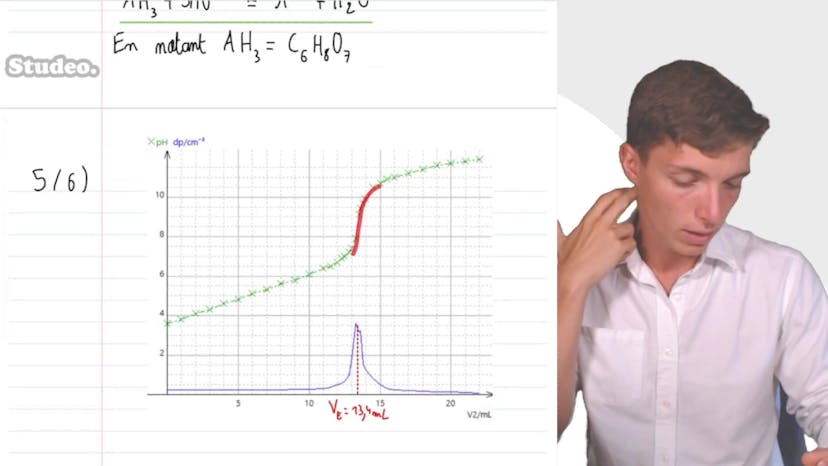
Acide citrique
Dans cette vidéo, Matisse de Studio explique comment déterminer la concentration en acide citrique dans un citron. Il commence par présenter la formule 3D de l'acide citrique et nous demande d'établir sa formule semi-développée et sa formule brute. En utilisant la représentation 3D, on identifie les fonctions acide carboxylique et hydroxyle de l'acide citrique. La formule brute est alors déduite en comptant les atomes de carbone, d'hydrogène et d'oxygène, ce qui donne C6H8O7.
Ensuite, Matisse explique les différentes méthodes de titrage adaptées pour titrer cet acide citrique. Il mentionne le titrage ph-métrique, qui est approprié pour un acide, et le titrage conductimétrique, qui peut être utilisé pour une espèce chargée comme la base conjuguée de l'acide citrique. Il explique que le titrage colorimétrique n'est pas envisagé, car aucune information sur la couleur du réactif n'a été donnée.
Par la suite, Matisse prépare une solution diluée de jus de citron en prélevant 10 ml de jus et en le complétant avec de l'eau distillée jusqu'à 100 ml. Il dose ensuite un volume de cette solution diluée avec de la soude de concentration C2 de 0,1 mol/L. À chaque ajout de la solution titrante, il relève le pH. Il explique également comment écrire l'équation de la réaction support du dosage, en notant que trois protons peuvent être enlevés de l'acide citrique.
En utilisant un programme informatique, Matisse trace la courbe du pH en fonction du volume de solution titrante versée et sa dérivée par rapport au volume. Il détermine le volume équivalent en repérant le pic de la dérivée qui correspond à un saut important de pH. La valeur du volume équivalent est de 13,4 mL.
Enfin, Matisse utilise la formule de la relation entre les quantités de matière pour déduire la concentration en quantité de matière d'acide citrique dans le jus de citron. Il considère les coefficients stoichiométriques dans cette équation et obtient une concentration de 4,5 x 10-2 mol/L. Après avoir pris en compte la dilution préalablement effectuée, la concentration en acide citrique du jus de citron est de 0,45 mol/L.
En résumé, cette vidéo explique comment déterminer la concentration en acide citrique dans un citron en utilisant différentes méthodes de titrage. Elle aborde également la nomenclature et l'utilisation des coefficients stoichiométriques.
Physique-Chimie
Chimie
Terminale

Pureté d'un bijou en or
Dans ce cours, nous parlons de l'or égal ou l'or royal, qui est utilisé par les bijoutiers pour tester la pureté des bijoux en or. Pour cela, un bijoutier utilise de l'acide 18 carats et une pierre de touche. Il gratte le bijou sur la pierre, puis dépose une goutte d'acide sur le dépôt jaunâtre. Si le dépôt reste intact, cela signifie que le bijou est en or 18 carats. S'il disparaît, le bijou est plaqué or, et s'il rougit, le bijou est d'un or moins pur, comme le 14 carats.
Ensuite, nous parlons de la composition d'un flacon de 20 mL d'acide 18 carats. Le flacon contient 15 mL d'acide chlorhydrique et 5 mL d'acide nitrique à 60%. Nous utilisons la densité de chaque solution pour déterminer la masse d'acide nitrique et d'acide chlorhydrique dans le flacon. Finalement, nous trouvons une masse d'acide chlorhydrique de 7,12 g et une masse d'acide nitrique de 4,11 g.
Enfin, nous déterminons la concentration en ion oxonium de cette solution. Les acides chlorhydrique et nitrique sont totalement dissociés dans l'eau, nous les écrivons donc comme H3O+ et Cl-. En utilisant la quantité de matière des acides, nous trouvons que la solution contient 0,2 mol d'ion oxonium provenant de l'acide chlorhydrique et 0,065 mol d'ion oxonium provenant de l'acide nitrique. En faisant la somme, nous obtenons une concentration de 0,265 mol d'ion oxonium dans la solution globale, ce qui correspond à une concentration de 13,3 mol par litre.
En conclusion, ce cours explique comment tester la pureté d'un bijou en or à l'aide d'acide 18 carats et d'une pierre de touche. Il donne également des informations sur la composition d'un flacon d'acide 18 carats et la concentration en ion oxonium de cette solution.
Physique-Chimie
Physique
Terminale

Ambulance
Dans cette vidéo éducative sur l'ambulance, nous sommes présentés à un exercice classique qui implique le calcul du décalage de fréquence. L'ambulance passe et émet un son à une fréquence de 435 Hz alors qu'elle s'éloigne d'un piéton immobile à une vitesse de 80 km/h. Pour trouver le décalage d'opéraire, nous pouvons utiliser la formule delta f, qui est moins fe fois v sur v son plus v. Nous rappelons que la célérité du son est de 345 m/s et la conversion de km/h en m/s est nécessaire. Nous trouvons que le delta f est moins 26 Hz, ce qui signifie que le piéton entend une fréquence de 409 Hz. Cette fréquence est plus grave que celle émise par l'ambulance, ce qui est cohérent avec notre observation de la baisse de fréquence lorsqu'un véhicule s'éloigne de nous.
Physique-Chimie
Physique
Terminale

Le radar
Dans cette vidéo, Layla explique le principe de fonctionnement d'un radar. L'onde FE émise par le radar et réfléchie sur le véhicule revient avec une fréquence différente due à l'effet Doppler. La formule pour calculer la vitesse du véhicule est V= delta F x C / 2FE cos alpha. La conversion de la vitesse en mètre par seconde en kilomètre heure est de 1 m/s = 3.6 km/h. Layla a trouvé une vitesse de 147 km/h pour le véhicule mesuré par le radar.
Physique-Chimie
Physique
Terminale

Alarme incendie
Dans ce cours, Laëla de Studio donne un exercice sur une alarme incendie en utilisant l'intensité sonore en watts par mètre carré à une distance d'un mètre. Elle rappelle la surface d'une demi-sphère et explique comment passer de l'intensité sonore à la puissance sonore. Après avoir isolé la formule, elle applique les données du rayon de la sphère pour trouver la puissance sonore. La vidéo souligne l'importance de toujours utiliser les unités appropriées et de faire attention aux chiffres significatifs. Poser des questions en commentaire est encouragé.
Physique-Chimie
Physique
Terminale

Sonar
Le cours explique comment fonctionne un sonar pour mesurer la vitesse d'un sous-marin dans l'eau en utilisant la formule de l'effet Doppler. Le décalage en fréquence est calculé en utilisant la fréquence émise et la fréquence reçue, puis la vitesse du sous-marin est trouvée en utilisant cette formule. Enfin, la vitesse est convertie en km/h à partir de m/s. La vidéo est instructive et les questions sont les bienvenues.


