 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Corrigés de BAC
Bac Maths
Terminale
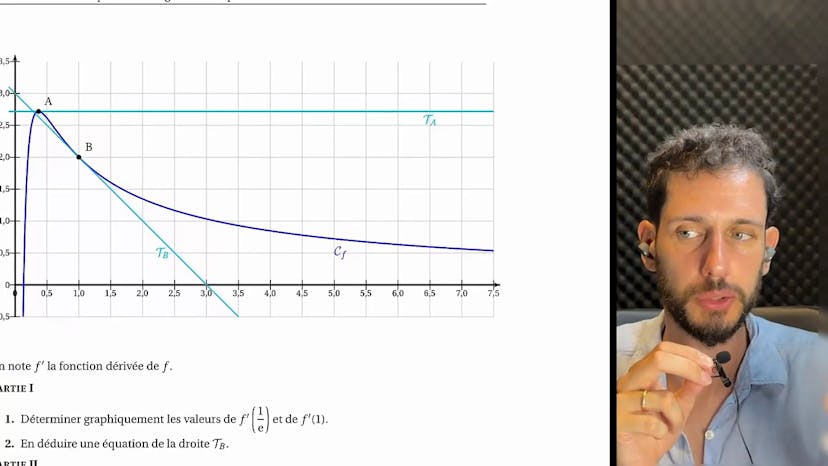
Exercice A (Logarithme et convexité)
L'exercice consiste à analyser graphiquement une fonction dérivable, définie sur l'intervalle (0,+∞), et représentée par une courbe dans un repère. On note A et B les points d'intersection de la courbe avec l'axe des abscisses, et on observe que la tangente en A est parallèle à cet axe
Corrigés de BAC
Bac Maths
Terminale

Exercice B (Equa diff et suites)
Aucun résumé n'est disponible pour cette vidéo
Corrigés de BAC
Bac Maths
Terminale
Probabilités - Métropoles 2021
Aucun résumé n'est disponible pour cette vidéo
Corrigés de BAC
Bac Maths
Terminale
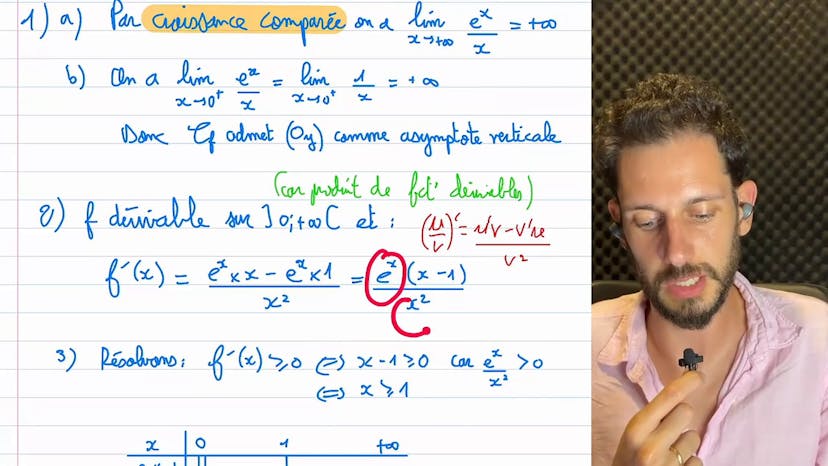
Fonctions exponentielle - Métropoles 2021
Aucun résumé n'est disponible pour cette vidéo
Corrigés de BAC
Bac Physique-Chimie
Terminale
Analyse d’un pigment à base d’oxyde de fer (1)
Dans cette vidéo, nous nous intéressons à l'analyse d'un pigment à base d'oxyde de fer. Un pigment est une espèce chimique colorante et insoluble dans le milieu qu'elle colore. Dans cet exercice, nous analysons une poudre colorante contenant un pigment d'oxyde de fer de formule Fe2O3.
Le fabricant indique que la teneur en oxyde de fer de cette poudre est de 5%. Nous allons donc réaliser une analyse quantitative de ce produit en utilisant un dosage par étalonnage.
Dans la première étape, nous préparons une gamme d'étalons contenant des ions fer 3. Nous réalisons ensuite une courbe d'étalonnage à partir des mesures spectrophotométriques sur des solutions de concentration connue. Enfin, nous effectuons la préparation et l'analyse de l'échantillon.
Dans la partie A de l'exercice, nous préparons une gamme d'étalons à partir de la solution mère S0, qui contient les ions fer 3 en milieu acide à une concentration de 25,0 mg par litre. Pour cela, nous dissolvons du chlorure de fer 3 exahydraté solide de formule FECL3-6H2O. L'équation de dissolution de ce chlorure de fer 3 exahydraté est la suivante : FECL3-6H2O → FE3+ + 3CL- + 6H2O.
Pour déterminer la masse de soluté nécessaire à l'obtention de la solution S0, nous utilisons la quantité de matière en ion fer 3. Cette quantité de matière est égale à la concentration massique multipliée par le volume de la solution, divisée par la masse molaire des ions fer 3.
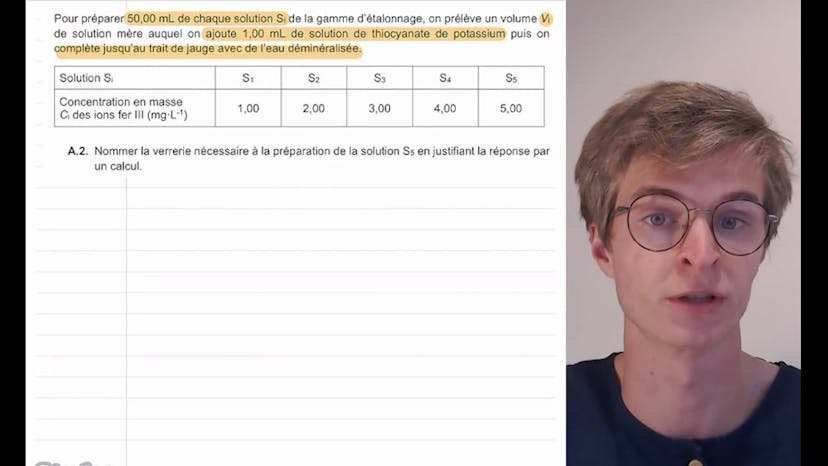
Dans la partie B de l'exercice, nous préparons différentes solutions SI de la gamme d'étalonnage en diluant la solution mère avec de l'eau déminéralisée et en ajoutant de la solution de thiocyanate de potassium. La masse de solution mère à prélever pour la préparation de la solution S5 est calculée en utilisant la conservation de la quantité de matière et de la masse lors d'une dilution.
Dans la partie C de l'exercice, nous réalisons un spectre d'absorption d'une solution de fer 3 en présence de thiocyanate. La couleur de la solution est déterminée en trouvant la longueur d'onde du maximum d'absorption et en prenant la couleur complémentaire. La longueur d'onde lambda0 la plus adaptée pour effectuer les mesures d'absorbance est également indiquée.
Si vous avez des questions, n'hésitez pas à les poser en commentaire et nous y répondrons avec plaisir.
Corrigés de BAC
Bac Physique-Chimie
Terminale
Analyse d’un pigment à base d’oxyde de fer (2)
Dans cette vidéo, Théobald de Cidéo aborde l'analyse d'un pigment à base d'oxyde de fer. Le pigment a une espèce chimique colorante insoluble dans le milieu qu'elle colore. L'objectif est de vérifier la teneur en oxyde de fer annoncée par le fabricant, qui affirme que la poudre contient 5% d'oxyde de fer.
La première partie de l'exercice consiste en la préparation d'une gamme étalon contenant des ions de fer. Ensuite, une courbe d'étalonnage est réalisée à l'aide de mesures spectrophotométriques pour établir la relation entre l'absorbance et la concentration molaire. Cette courbe d'étalonnage est compatible avec la loi de Berlembert, selon laquelle l'absorbance est proportionnelle à la concentration.
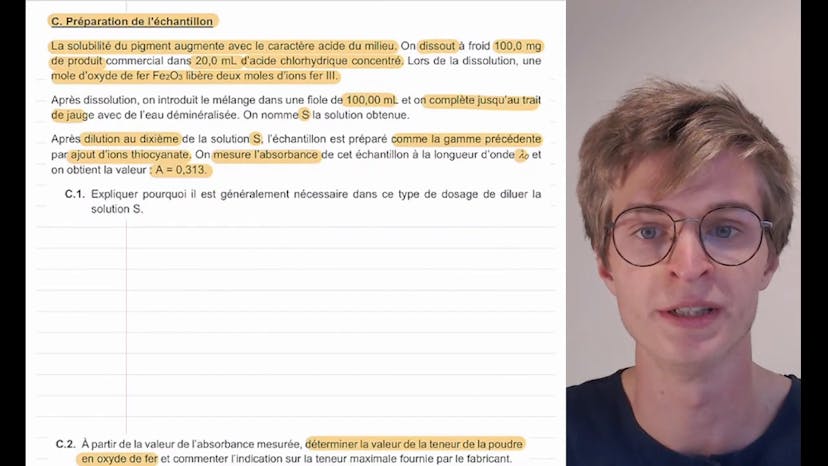
La deuxième partie de l'exercice concerne la préparation de l'échantillon. Il est mentionné que la solubilité du pigment augmente avec le caractère acide du milieu. Ainsi, 100 mg de produit sont dissous à froid dans 20 mg d'acide chlorhydrique concentré pour augmenter la solubilité du pigment. Le mélange est ensuite dilué et une fiole de 100 mg est complétée avec de l'eau déminéralisée. La solution obtenue est notée S.
Dans la troisième partie de l'exercice, la solution S est diluée au dixième pour préparer l'échantillon. L'absorbance de l'échantillon est mesurée à la longueur d'onde lambda0, et on obtient une valeur de 0,313.
Il est expliqué que la dilution de la solution S est nécessaire car la loi de Berlembert s'applique généralement aux solutions diluées. En utilisant la relation entre l'absorbance et la concentration massique en fer, la valeur de la teneur en oxyde de fer dans la poudre peut être déterminée. Le calcul est effectué en remontant les étapes : concentration massique en fer 3 dans l'échantillon, concentration massique en fer 3 dans la solution S, quantité d'ion fer dans la solution S, quantité de matière en oxyde de fer, et enfin la teneur en oxyde de fer dans la poudre.
Après les calculs, il est conclu que la teneur en oxyde de fer de la poudre est de 5,1%, ce qui est conforme à l'annonce du fabricant qui indiquait une teneur de 5%.
Cet exercice permet de comprendre comment réaliser un dosage par étalonnage et de vérifier les assertions d'un fabricant en utilisant des mesures spectrophotométriques.
Corrigés de BAC
Bac Physique-Chimie
Terminale
Synthèse d’un ester à odeur florale (1)
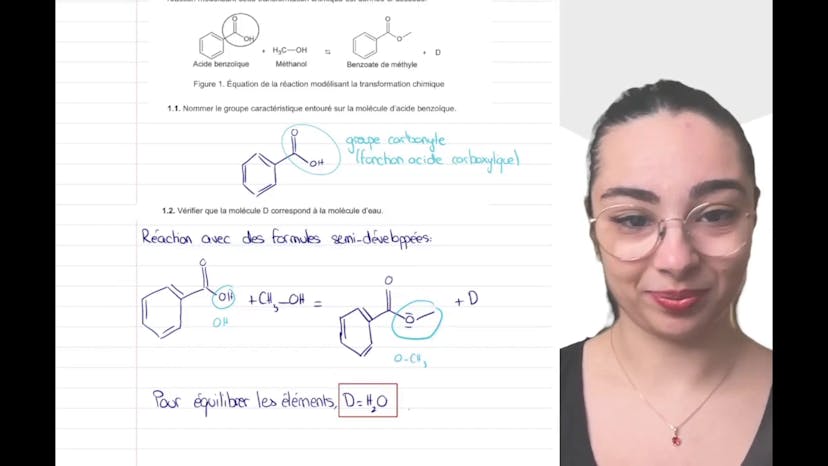
Aujourd'hui, nous allons étudier la synthèse d'un estère à odeur florale. Cette réaction consiste à synthétiser le benzoate de méthyl à partir de l'acide benzoïque et du méthanol. Le premier objectif est de nommer le groupe caractéristique sur la molécule d'acide benzoïque, qui est le groupe carbonyl COOH, également appelé fonction acide carboxylique. Ensuite, nous devons vérifier si la molécule D correspond bien à la molécule O, qui est un sous-produit de la réaction. Pour ce faire, nous examinons les éléments chimiques présents dans les molécules et concluons que tous ceux qui ne se trouvent pas dans les molécules écrites sont présents dans D. L'équilibre des molécules nous montre que le OCH3 est égal à H2O. Pour la suite de cette synthèse, nous vous invitons à regarder la partie 2 de la vidéo.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Synthèse d’un ester à odeur florale (2)
Le cours aborde la deuxième partie du sujet de BAC sur la synthèse d'un estère à odeur florale. Il explique le rôle de l'acide sulfurique dans le protocole de synthèse en tant que catalyseur pour augmenter la vitesse de la réaction. Ensuite, il présente les montages utilisés pour chauffer à reflux et explique l'utilité d'un réfrigérant à boules pour éviter les pertes de réactifs. Le chauffage à reflux permet d'augmenter la vitesse de la réaction et d'éviter de perdre de la matière. Le cours aborde également les pictogrammes de sécurité et les précautions opératoires à prendre lors de la manipulation des produits chimiques. Le choix d'ajouter de l'eau salée dans l'étape 2 est expliqué en raison de la solubilité des produits à éliminer de la phase aqueuse. Les espèces chimiques contenues dans chaque phase sont identifiées, ainsi que l'équation montrant comment l'ajout de solution aqueuse d'hydrogénocarbonate de sodium permet de transformer l'acide benzoïque en benzoate.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Synthèse d’un ester à odeur florale (3)
Salut à tous ! Aujourd'hui, nous continuons à traiter de la synthèse d'un estère, dans le cadre du sujet de Pâques de Polynésie 2022. Nous nous intéressons maintenant à l'identification de la molécule par spectroscopie infrarouge. La spectroscopie infrarouge ne permet pas de déterminer exactement la molécule, mais peut donner des indices et éliminer certaines possibilités.
Nous observons une bande CO, entre 1650 et 1740, avec une forte intensité d'absorption, ce qui correspondrait à l'estère que nous étudions. Nous repérons également une autre bande CO, entre 1000 et 1300, qui pourrait correspondre à une autre partie de la molécule. Nous identifions également les bandes CH, qui indiquent la présence de la chaîne carbonée.
En revanche, nous ne détectons pas la bande OH, qui confirme que les réactifs de départ (acide carboxylique et alcool) ont bien réagi et disparu lors de la synthèse.
En résumé, nous observons les bandes CO et CH, ainsi que la liaison simple C-O. Nous ne détectons pas la bande OH, ce qui suggère l'absence d'acide benzoïque.
J'espère que ce résumé vous a été utile ! À bientôt pour la suite du cours.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Synthèse d’un ester à odeur florale (4)
Le cours traite de la synthèse d'un ester et de la détermination du rendement de cette synthèse. L'objectif est de déterminer les quantités de réactifs nécessaires et de montrer comment améliorer le rendement de la réaction.
Le cours commence par récapituler les étapes de la synthèse et les considérations expérimentales. Ensuite, le produit de la réaction est identifié à l'aide du spectre infrarouge.
La partie principale du cours porte sur les questions de rendement. Il est expliqué comment calculer les quantités de réactifs nécessaires à partir des masses et des masses moléculaires. L'importance des conversions entre les masses et les masses moléculaires est soulignée. L'utilisation de l'analyse dimensionnelle est également mentionnée comme une méthode utile.
Le concept de proportions stoichiométriques est expliqué, et il est rappelé qu'il faut faire attention aux coefficients dans l'équation de la réaction. Un tableau d'avancement est ensuite complété pour représenter la progression de la réaction.
Les quantités de matière des différentes espèces à l'état final sont calculées en utilisant les données expérimentales. Le rendement de la synthèse est ensuite estimé à environ 67%.
Enfin, des suggestions pour améliorer le rendement de la synthèse sont données. Il est expliqué qu'il faut introduire un excès de réactifs et éliminer l'eau au fur et à mesure du processus de réaction. Le procédé de Dean-Stark est mentionné comme une méthode pour éliminer l'eau.
En conclusion, ce cours traite de la détermination du rendement d'une synthèse d'un ester, en expliquant les étapes nécessaires pour calculer les quantités de réactifs et en donnant des suggestions pour améliorer le rendement.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Synthèse d’un ester à odeur florale (5)
Le cours traite d'un exercice de synthèse d'esters et de dosage spectrophotométrique. L'objectif est de déterminer la quantité de matière en ion benzoate à l'aide d'un dosage spectrophotométrique.
Le cours explique d'abord qu'il faut régler le spectrophotomètre à la longueur d'onde où l'absorbance est maximale, c'est-à-dire 270 nm. Ensuite, il présente les différents domaines spectraux (violet, rouge, infrarouge, ultraviolet) avec les longueurs d'onde correspondantes.
Ensuite, le cours aborde la dilution de la solution obtenue après la synthèse. Il explique qu'il faut diluer 100 fois cette solution pour obtenir la solution S3. Il précise également l'importance de connaître la concentration et le volume pour réaliser une dilution précise.
Enfin, le cours présente les mesures spectrophotométriques et utilise la loi de Beer-Lambert pour trouver la concentration de la solution S3. Il explique ensuite que la solution a été diluée 100 fois, ce qui permet de retrouver la concentration de la solution après la synthèse. Cette concentration correspond à la quantité de matière restante en ion benzoate et en acide benzoïque.
Le cours conclut en précisant que cet exercice est noté sur 10 points et qu'il faut environ deux heures pour le traiter. Il mentionne également qu'il reste deux autres exercices optionnels à traiter.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Un tracteur gravitationnel pour dévier un astéroïde (1)
Bonjour à tous, Laila de Studio ici. Aujourd'hui, nous allons faire l'exercice A du sujet de physique de l'année dernière, Polynésie 2022, jour 1. Cet exercice porte sur la gravitation et utilise la loi de Newton, le champ de gravitation et la loi de Kepler. Nous devons dévier un astéroïde qui se dirige vers la Terre en utilisant un tracteur gravitationnel. Dans cet exercice, nous devons représenter la force gravitationnelle exercée par l'engin spatial sur l'astéroïde. Cette force est attractive, ce qui signifie que l'engin spatial attire l'astéroïde. La durée de cette interaction gravitationnelle est très courte par rapport à la période orbitale de l'astéroïde, ce qui signifie que nous pouvons considérer la trajectoire de l'astéroïde comme presque rectiligne. L'engin spatial reste à une distance constante de l'astéroïde pour cette même raison. Nous devons faire un schéma de la trajectoire de l'astéroïde et représenter les variations des vecteurs vitesse. Nous devons également déterminer la direction dans laquelle l'engin spatial doit être placé pour dévier l'astéroïde de sa trajectoire. Pour cela, nous utilisons la troisième loi de Newton qui nous indique que la force exercée doit être dans la même direction que la variation de vitesse. Nous devons donc placer l'engin spatial dans la direction de cette variation de vitesse pour dévier l'astéroïde au maximum. J'espère que cette vidéo vous a été utile. Dans la prochaine vidéo, nous aborderons la seconde partie de l'exercice et étudierons plus en détail le fonctionnement du tracteur gravitationnel.


