 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI
La vitamine C sans sucre (2)
Dans cette vidéo, Théobald de Studio aborde la synthèse de l'aspartame à partir de la vitamine C, plus précisément de l'acide ascorbique. On nous explique que cette synthèse se déroule en plusieurs étapes, et que dans cette transcription, on se concentre sur la première étape qui consiste à transformer l'espèce chimique A en l'espèce chimique C.
Différents protocoles sont présentés, avec des masses et des rendements variables. Dans la première question, on nous demande de déterminer le volume de réactif B liquide à prélever dans le protocole 1. Pour cela, on utilise la formule masse divisée par masse volumique et on obtient un volume de 1,0 millilitres.
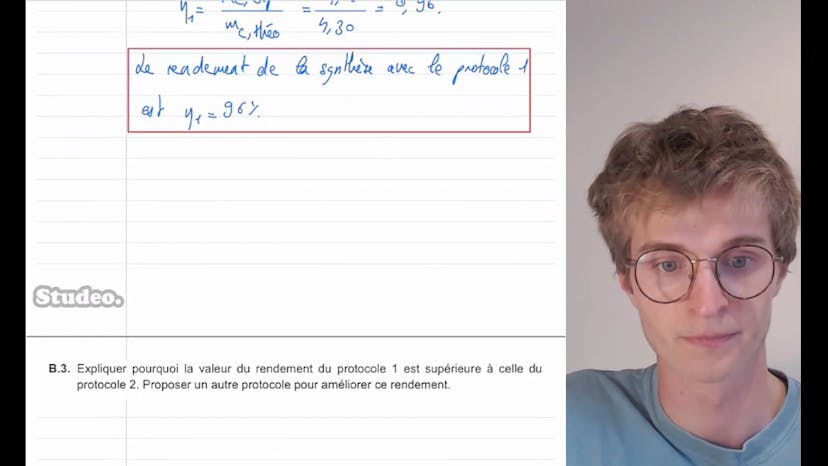
La deuxième question porte sur le rendement de la synthèse avec le protocole 1. Le rendement se calcule en divisant la masse de produit C obtenue expérimentalement par la masse de produit C obtenue théoriquement. On nous donne la masse expérimentale de 4,12 grammes et on calcule la masse théorique de 4,30 grammes. Le rendement est donc de 96%.
Ensuite, on nous demande pourquoi le rendement du protocole 1 est supérieur à celui du protocole 2, et de proposer un autre protocole pour améliorer le rendement. La différence entre les deux protocoles réside dans la quantité de matière de réactif A utilisée. Dans le protocole 1, on en utilise plus, ce qui permet à A d'être en excès et d'augmenter le rendement. Pour améliorer le rendement, on propose d'éliminer un des produits, comme l'eau, pour favoriser la production des produits.
Enfin, en analysant un tableau présenté, on identifie le rôle du palladium sur carbone. On remarque que sa présence accélère la durée de la réaction, ce qui indique que le palladium sur carbone est un catalyseur.
La partie C de cet exercice sera traitée dans une prochaine vidéo.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

La vitamine C sans sucre (3)
Dans cette vidéo, Théobald de Cidéo aborde le sujet de l'acide ascorbique, qui est le nom scientifique de la vitamine C. Il explique comment dissoudre cet acide dans l'eau et présente un exercice qui concerne le BAC de 2022 en Amérique du Nord. L'exercice consiste à calculer la concentration en quantité de matière de l'acide ascorbique lorsqu'un comprimé de 0,50 g est dissout dans 200,0 ml d'eau. Pour cela, Théobald utilise la formule de concentration en quantité de matière qui est le nombre de moles divisé par le volume de la solution. Il montre ensuite comment calculer cette concentration en utilisant la masse d'acide ascorbique, la masse molaire de l'acide ascorbique et le volume de la solution. Il obtient une concentration de 1,4 fois 10 moins 2 moles par litre, ce qui correspond à la réponse B de l'exercice. Ensuite, Théobald explique que l'acide ascorbique est un acide faible et que sa réaction avec l'eau est une réaction acido-basique. Il présente les couples d'espèces en présence et montre que la réaction se fait entre l'acide ascorbique et l'eau pour former les ions ascorbate et H3O+. Il mentionne également que le pH à l'équilibre de la solution est de 2,9. Théobald montre ensuite comment montrer que la constante d'acidité Ka peut s'écrire sous la forme donnée dans l'énoncé de l'exercice en utilisant les concentrations en ions H3O+ et ascorbate à l'équilibre et la concentration en quantité de matière apportée d'acide ascorbique. Il utilise un tableau d'avancement pour caractériser l'équilibre et montre que les concentrations en ions H3O+ et ascorbate à l'équilibre sont égales. En utilisant ces valeurs, il détermine la constante d'équilibre Ka. Il utilise ensuite Ka pour calculer le pKa du couple acide-ascorbique-ion-ascorbate, qui est de 3,9. Enfin, Théobald demande de représenter le diagramme de prédominance du couple ascorbique-ion-ascorbate en fonction du pH et de déduire la forme majoritaire dans l'estomac, où le pH est d'environ 2. Il explique que l'acide prédomine à pH faible et la base à pH élevé, et montre que dans l'estomac, qui a un pH de 2, la forme majoritaire est l'acide ascorbique. Théobald conclut en encourageant les spectateurs à poser des questions en commentaire et leur souhaite bonne chance pour leurs révisions.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

La vitamine C sans sucre (4)
Dans cette vidéo, Théoval de Cedéo poursuit l'exercice sur la vitamine C en essayant de déterminer la masse d'acide ascorbique dans un comprimé de vitamine C. Le fabricant donne des informations sur la larose corbine, un comprimé contenant 500mg de vitamine C sous forme d'acide ascorbique et d'ascorbate de sodium. L'objectif est de vérifier si la masse d'acide ascorbique dans un comprimé est bien de 200mg.
Pour cela, Théoval dissout un comprimé dans de l'eau distillée pour obtenir une solution S de volume V0 égal à 250mL. Un volume de 40mL de cette solution est prélevé et titré avec une solution d'hydroxyde de sodium pour déterminer la masse en acide ascorbique.
La réaction de titrage est la suivante : acide ascorbique + hydroxyde de sodium → ascorbate + eau. La conductivité de la solution est mesurée tout au long du titrage.
Les courbes de conductivité en fonction du volume d'hydroxyde de sodium versé montrent une augmentation de la conductivité avec l'augmentation du volume versé. Avant l'équivalence, les concentrations des ions HO-, Na+ et ascorbate augmentent. Après l'équivalence, la concentration en ions ascorbate ne change plus. Cette évolution de la conductivité est cohérente avec les observations expérimentales.
En utilisant les courbes, il est possible de déterminer la concentration en acide ascorbique de la solution titrée, qui est de 4,3 x 10-3 mol/L. En utilisant cette concentration, le volume de la solution S0 et la masse molaire de l'acide ascorbique, la masse d'acide ascorbique contenue dans un comprimé est calculée et trouvée être de 0,19 g.
En comparant cette valeur à la valeur annoncée par le fabricant (200 mg), on trouve un rapport de 1, ce qui indique que la mesure est compatible avec la valeur de référence. Ainsi, la valeur mesurée est cohérente avec celle indiquée par le fabricant.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI
La pente d'eau de Montech (1)
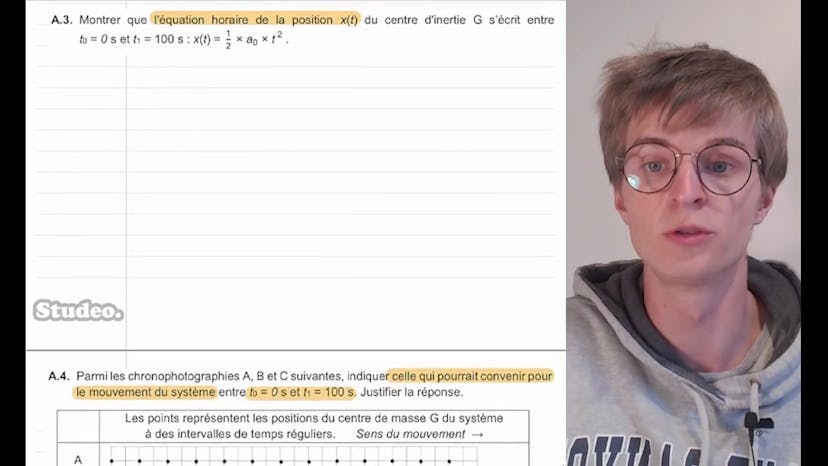
Aujourd'hui, nous étudions la pente d'eau de Montaigue, un ascenseur à bateau devenu un site touristique depuis 2021. L'ascenseur permettait de monter ou descendre les bateaux en 20 minutes. Dans cette première partie, nous étudions le mouvement du système, dont le centre de masse est G. Le système se déplace selon l'axe OX avec un angle alpha par rapport à l'horizontale. Nous montrons que l'accélération du système est constante entre t = 0 et t1 = 100 secondes, et qu'elle vaut A0 = 1,20 x 10^-2 m/s^2. En intégrant l'accélération, nous obtenons l'équation horaire de la vitesse, V(t) = A0t. En intégrant la vitesse, nous obtenons l'équation horaire de la position, x(t) = 1,5A0t^2. En analysant les chronophotographies, nous déterminons que la chronophotographie C représente le mouvement du système entre t0 et t1, car les intervalles de temps et de distance sont réguliers.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

La pente d'eau de Montech (2)
Dans cette vidéo, Théobald continue l'exercice sur l'ascenseur à bateau. Dans la première partie, il étudie dynamiquement le système et dans la deuxième partie, il essaie de se placer loin du bateau pour l'observer à l'aide d'une lunette.
Le système est composé du bateau, de l'eau et du masque. Le centre de masse du bateau se déplace le long de la pente d'OX et est soumis à quatre forces : poids, réaction normale de la pente, forces automotrices et force de frottement du masque et de l'eau le long de la pente.
On nous demande de déterminer le schéma qui représente le mieux la situation entre deux moments donnés et de justifier notre réponse en associant chaque vecteur force aux forces décrites précédemment.
En étudiant la situation entre t0 et t1, on trouve que l'accélération est positive selon l'axe plus ux. Donc la somme des forces extérieures doit également être selon plus ux. En compar
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI
Synthèse d’un ester à odeur florale (1)
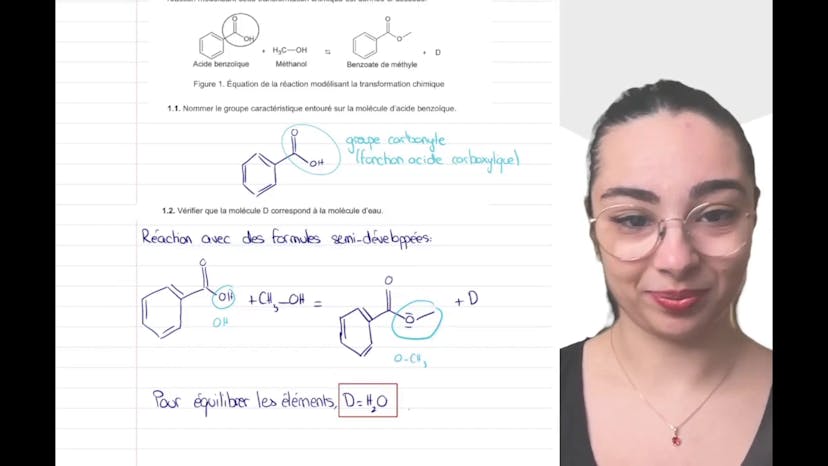
Aujourd'hui, nous allons étudier la synthèse d'un ester à odeur florale, qui est un exercice de chimie tombé au bac en Polynésie l'année dernière. L'objectif est d'étudier une réaction de synthèse et de réfléchir ensemble au protocole expérimental. La réaction que nous allons réaliser est la synthèse du benzoate de méthyl à partir d'acide benzoïque et de méthanol. La première étape consiste à nommer le groupe caractéristique entouré sur la molécule d'acide benzoïque, qui est un groupe carbonyl COOH, correspondant à la fonction acide carboxylique. Ensuite, nous devons vérifier que la molécule D correspond bien à la molécule O, c'est-à-dire les sous-produits de la réaction. Pour cela, nous examinons les éléments chimiques et constatons que tous ceux qui ne sont pas déjà présents dans les molécules écrites se retrouvent dans D. Nous remarquons que la molécule reste inchangée jusqu'à un certain point. Le groupement OH de l'acide benzoïque se transforme en un groupement OCH3 dans D. De plus, le méthanol est présent dans la molécule CH3OH. Ainsi, pour équilibrer ces molécules, D doit être égal à H2O. La suite de cette synthèse sera abordée dans une prochaine vidéo.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Synthèse d’un ester à odeur florale (2)
Le sujet du cours porte sur la synthèse d'un ester à odeur florale. Dans la première partie du cours, on a étudié les fonctions caractéristiques de la molécule à synthétiser. Dans cette deuxième partie, on se penche sur le protocole de synthèse en répondant à des questions expérimentales.
Tout d'abord, on nous demande de déterminer le rôle de l'acide sulfurique ajouté dans l'étape 1 du protocole. En général, de petites quantités d'additifs n'ont pas de rôle direct dans la réaction, mais peuvent servir de catalyseurs pour accélérer la vitesse de la réaction.
Ensuite, on nous demande d'identifier le montage correspondant à l'étape 1 du protocole. Le chauffage à reflux, consistant à chauffer le contenu d'un ballon sans rien perdre, se fait à l'aide d'un chauffe-ballon et d'un réfrigérant à boules. Le montage B répond à ces critères.
Le chauffage à reflux présente deux intérêts principaux : il augmente la vitesse de la réaction et évite les pertes de matière.
Ensuite, on nous demande d'analyser les pictogrammes de sécurité et de justifier les précautions prises. Les pictogrammes utilisés indiquent que des précautions doivent être prises en portant des gants, des blouses en coton et des lunettes de protection. De plus, il est recommandé de travailler sous une hotte pour ne pas inhaler les éventuelles vapeurs toxiques dégagées par les produits chimiques utilisés.
On nous demande également d'expliquer pourquoi de l'eau salée est ajoutée à l'étape 2 du protocole. L'ajout d'eau salée permet de séparer les produits indésirables présents dans la phase aqueuse, tels que l'acide benzoïque, du produit recherché, qui lui reste dans la phase organique. L'eau salée favorise la séparation des deux phases.
Pour finir, on nous demande de rédiger la réaction permettant de transformer l'acide benzoïque en benzoate en ajoutant de la solution aqueuse d'hydrogénocarbonate de sodium. La réaction se fait par un échange de protons : l'acide benzoïque réagit avec l'hydrogénocarbonate de sodium pour donner du benzoate et de l'acide carbonique. Cette réaction permet d'éliminer l'acide benzoïque de la phase organique.
En résumé, cette partie du cours porte sur le protocole de synthèse de l'ester à odeur florale. On a étudié le rôle de l'acide sulfurique, identifié le montage correspondant à l'étape 1, expliqué les précautions de sécurité à prendre, justifié l'ajout d'eau salée dans l'étape 2 et rédigé la réaction transformant l'acide benzoïque en benzoate.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Synthèse d’un ester à odeur florale (3)
Dans ce cours, nous continuons l'exercice 1 du sujet de Pâques de Polynésie 2022 sur la synthèse d'un estère. L'objectif est d'identifier la molécule obtenue par spectroscopie infrarouge. On observe une bande CO entre 1650 et 1740, ce qui indique la présence de l'estère recherché. Une autre bande d'absorption forte entre 1000 et 1300 correspond également à la CO. On observe également des bandes fines multiples pour les CH, ce qui confirme la présence de la chaîne carbonée. En revanche, on ne détecte pas de bande OH, ce qui suggère que les réactifs de départ ont bien été éliminés lors de la synthèse. En résumé, on identifie les bandes CO, CH et absence de bande OH, ce qui confirme la formation de la liaison C=O et l'élimination des réactifs.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Synthèse d’un ester à odeur florale (4)
Bonjour à tous, ici Leïla de Studio. Aujourd'hui, nous allons continuer notre exercice de synthèse d'un ester qui a été réalisé l'année dernière lors de Pâques. Pour récapituler les parties précédentes, nous avons déjà identifié les différentes étapes de la synthèse, justifié le protocole et abordé les considérations expérimentales. Dans la partie 3, nous avons identifié le produit de notre synthèse à l'aide d'un spectre infrarouge. Maintenant, nous allons nous intéresser aux questions de rendement.
Il est important de savoir non seulement quel produit nous avons fabriqué, mais aussi dans quelle quantité cela a été fait, pour que cela soit intéressant pour nous. Nous disposons des masses molaires nécessaires, nous rappelons la réaction chimique et à l'aide des données de l'étape 1 du protocole de synthèse, nous devons déterminer les quantités de réactif, appelées NAlcool et NAcide, utilisées dans la réaction.
Pour cela, nous devons utiliser les formules de conversion entre les masses et les masses molaires. Personnellement, je n'ai pas toutes ces formules en tête, mais j'utilise une approche basée sur l'analyse dimensionnelle pour vérifier leur validité. En utilisant les données dont nous disposons, nous pouvons dire que la quantité initiale d'alcool est de 99 millimoles. Soyez attentifs aux conversions entre les masses et les masses molaires, car c'est souvent là que se trouve le piège dans les exercices numériques. Il est important de vérifier que tout est cohérent.
Nous utilisons la même méthode pour l'acide. Donc ici, cela sera MAcide / MAcide, et nous obtenons 100 millimoles. Nous en déduisons ensuite que les réactifs ont été introduits dans des proportions stœchiométriques. Cela signifie que ces réactifs disparaissent à la même vitesse dans le tableau d'avancement. Ce terme signifie simplement que la quantité divisée par le coefficient stœchiométrique est la même. Pour résumer, nous avons trouvé que la quantité initiale d'alcool était d'environ 99 millimoles et la quantité initiale d'acide était d'environ 100 millimoles.
Ensuite, on nous demande de compléter le tableau d'avancement. Ce tableau présente les états initial, intermédiaire et final de la réaction. Nous avons donc deux ou trois lignes, selon la configuration. Dans l'état initial, nous énumérons les réactifs introduits, c'est-à-dire l'acide et l'alcool, et rien d'autre. Dans l'état intermédiaire, nous notons les réactifs consommés en soustrayant X, où X est l'avancement de la réaction. Nous notons également les produits formés, c'est-à-dire l'eau et l'ester, avec X comme coefficient. Pour l'état final, nous remplaçons X par XF, qui est notre avancement final. Le tableau d'avancement est un outil essentiel pour suivre l'évolution d'une réaction.
Ensuite, nous devons déterminer les quantités de matière de toutes les espèces présentes à l'état final, qui sont notées NAcide-X, NAlcool-X et NEster-X. Nous avons déjà calculé la quantité d'ester expérimentale, qui est de 9,11 grammes, ce qui correspond à environ 67 millimoles. Nous savons également que la quantité d'eau formée est similaire à celle de l'ester, soit 67 millimoles. Cette information, associée au tableau d'avancement, nous permet de déterminer les quantités restantes des réactifs, qui sont environ 33 millimoles pour l'acide et 32 millimoles pour l'alcool.
Ensuite, nous devons montrer que le rendement de la synthèse approche les 67%. Le rendement est le rapport entre la quantité obtenue et la quantité maximale théorique. Dans ce cas, nous avons calculé que nous avons obtenu 67 millimoles d'ester et la quantité maximale théorique est de 100 millimoles. Par conséquent, le rendement est d'environ 67%.
Enfin, nous devons proposer une méthode pour améliorer le rendement de la synthèse. Dans l'idéal, nous voudrions atteindre un rendement de 100%. Pour cela, nous devons examiner le coefficient de la réaction, Ka. Nous pouvons augmenter les quantités de réactifs en excès et réduire la quantité d'eau formée, car elle perturbe l'équilibre de la réaction en limitant la formation de l'ester. Une méthode efficace pour éliminer l'eau au fur et à mesure de la réaction est le procédé Dean-Stark.
J'espère que cette synthèse du cours vous a été utile. N'hésitez pas à poser vos questions dans les commentaires. À bientôt pour la partie finale de cet exercice.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Synthèse d’un ester à odeur florale (5)
Dans cette vidéo, Leïla explique comment réaliser un dosage spectrophotométrique pour vérifier la quantité de matière en ion benzoate dans une solution, dans le cadre d'un exercice. Elle précise que cette méthode de dosage est souvent utilisée car elle est simple.
Elle explique que l'ion benzoate est obtenu à partir de l'acide benzoïque grâce à l'hydrogénocarbonate de sodium. Le but est de déterminer la quantité de matière restante en ion benzoate dans la phase aqueuse en utilisant un spectrophotomètre.
Leïla explique qu'il est nécessaire de régler le spectrophotomètre à la longueur d'onde d'absorbance maximale. Elle donne des indications sur les longueurs d'onde correspondant aux différents domaines du spectre électromagnétique, afin d'identifier cette longueur d'onde maximale.
Ensuite, elle décrit les étapes du dosage spectrophotométrique, qui consiste à diluer la solution obtenue après la synthèse. Elle souligne l'importance de prendre en compte les dilutions lors des mesures. Elle explique comment préparer une solution S3 en diluant la solution mère S0 dans une fiole jaugée de 100 ml.
Leïla donne les mesures spectrophotométriques et montre comment utiliser la loi de Birlambert pour retrouver la concentration en ion benzoate. Elle explique que la solution a été diluée 100 fois, ce qui permet de retrouver la concentration finale en utilisant la concentration mesurée précédemment. Enfin, elle conclut que la quantité de matière d'ion benzoate restante est de 3,3 x 10^-2 mol, ce qui correspond également à la quantité de matière d'acide benzoïque restante.
Elle termine en précisant que cet exercice est noté sur 10 points et recommande de compter environ deux heures pour le traiter. Elle rappelle également qu'il y a deux autres exercices optionnels à choisir.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Un tracteur gravitationnel pour dévier un astéroïde (1)
Dans cette vidéo, Laila de Studio résume l'exercice A du sujet de physique de l'année dernière, Polynésie 2022, jour 1, qui traite de la gravitation. L'exercice concerne l'utilisation d'un tracteur gravitationnel pour dévier un astéroïde et fait référence aux lois de Newton, au champ de gravitation et à la loi de Kepler. Laila explique que l'engin spatial exerce une faible force sur l'astéroïde pour modifier son orbite et éviter une collision avec la Terre. Elle commence par une étude générale de la déviation de l'astéroïde, représentant la force gravitationnelle exercée par l'engin spatial sur l'astéroïde. Elle explique que cette interaction gravitationnelle se produit pendant une durée delta t, qui est très courte par rapport à la période orbitale de l'astéroïde. L'astéroïde est considéré comme ayant une trajectoire quasiment rectiligne pendant cette durée. L'engin spatial se maintient à une distance constante de l'astéroïde pour cette raison. Laila demande ensuite aux spectateurs de faire un schéma représentant les variations des vecteurs vitesse, en expliquant que l'objectif est de vérifier que la somme de la vitesse initiale et de la variation de vitesse est égale à la vitesse finale. Elle mentionne également qu'il y a une direction privilégiée dans laquelle l'engin spatial doit être placé pour dévier l'astéroïde de sa trajectoire, et explique que cette direction est celle de la variation de vitesse. Elle justifie cette réponse en utilisant la troisième loi de Newton. En conclusion, Laila annonce qu'elle traitera de la seconde partie de l'exercice dans une prochaine vidéo.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Un tracteur gravitationnel pour dévier un astéroïde (2)
Le cours porte sur la déviation d'un astéroïde appelé Apophis à l'aide d'un tracteur gravitationnel. Dans la première partie, la force d'interaction gravitationnelle entre l'engin spatial et l'astéroïde est calculée, donnant une valeur de 0,2 N. Ensuite, la deuxième loi de Newton est appliquée dans le référentiel héliocentrique pour obtenir une expression de la durée d'utilisation Δt en fonction de la variation de vitesse Δv. Ensuite, on estime qu'une augmentation de 2 x 10-6 m/s de la norme du vecteur vitesse est suffisante pour dévier l'astéroïde. La durée d'utilisation Δt dans ce cas est calculée en utilisant les valeurs données dans l'énoncé. On nous dit également que l'utilisation du tracteur gravitationnel augmente le rayon de la trajectoire de l'astéroïde, ce qui peut éviter l'impact avec la Terre. La troisième loi de Kepler est établie pour Apophis dans le référentiel héliocentrique, reliant le rayon et la période de l'astéroïde. Enfin, la valeur de la période de révolution après l'utilisation du tracteur gravitationnel est calculée en ajoutant une augmentation de 15 minutes à la période initiale. Utilisant la loi de Kepler, le nouveau rayon de la trajectoire est calculé, ainsi que l'écart de rayon entre l'ancienne et la nouvelle trajectoire. La correction de cet exercice permet de revoir des notions importantes telles que la force gravitationnelle, la loi de Kepler et le principe fondamental de la dynamique.


