 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
Terminale

Le PET
Dans cette vidéo, nous allons nous intéresser à la molécule PET (polyéthylène terephthalate). L'entreprise française Carbios a développé une enzyme capable de décomposer le PET afin de le rendre recyclable. Le PET est largement utilisé dans notre quotidien, notamment pour les bouteilles, les cartes de crédit et les filets de textile. Pour identifier les groupes caractéristiques de cette molécule, nous observons un fragment de PET et utilisons une représentation topologique. Les boules noires représentent les carbones, les boules blanches représentent les hydrogènes et les boules rouges représentent les oxygènes. En identifiant les motifs à partir d'un cycle à 6 carbones, nous pouvons déduire la structure du polymère PET. Quant à la représentation topologique, nous déduisons le nombre de liaisons en fonction des groupements présents. Par exemple, dans le cycle, chaque carbone forme 3 liaisons avec les carbones adjacents, ce qui indique la présence de 3 doubles liaisons. En progressant ainsi, nous pouvons représenter les groupements alcènes et estères présents dans le PET. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Le Rilsan
Le Rilsan, également connu sous le nom de polyamide 11, est un polymère thermoplastique utilisé dans diverses applications telles que les fibres textiles synthétiques, les conduites flexibles et les filets de pêche. Il est obtenu par polycondensation catalysée par des ions hydrogène H+ et de l'acide 11-amino-oundécanoïque issu de l'huile de Rilsan. Le Rilsan est l'un des premiers bioplastiques agrosourcés non biodégradables. Pendant la synthèse, l'eau est continuellement éliminée à haute température (entre 200°C et 220°C). La matière première étant l'huile de Rilsan, le Rilsan est considéré comme un bioplastique agrosourcé. La forme topologique du monomère du Rilsan est une longue chaîne carbonée avec un groupement amine à une extrémité et un groupement carboxyle à l'autre. La polymérisation du Rilsan se fait par polycondensation, où le monomère réagit avec lui-même en formant des liaisons amide. La polymérisation est optimisée cinétiquement grâce à la catalyse acide et à de hautes températures. L'eau est éliminée lors de la synthèse car elle est produite en remplaçant le NH2 dans la doublure de la chaîne carbonée. En éliminant l'eau, on diminue sa concentration dans la réaction, ce qui favorise le déplacement de l'équilibre vers la formation du produit final. Ce processus permet d'obtenir un meilleur rendement de réaction. La vidéo donne une explication détaillée de chaque étape de la polymérisation du Rilsan.
Physique-Chimie
Chimie
Terminale

Insaturation
Dans cette vidéo, Mathis du studio aborde la notion d'insaturation qui est un concept chimique. Il explique que le nombre d'insaturation peut être calculé à partir de la formule brute d'une molécule selon la formule suivante : deux fois le nombre de carbone, plus deux, moins le nombre d'hydrogène, plus le nombre d'azote, moins le nombre d'halogène, le tout divisé par deux.
Mathis utilise l'exemple de l'alizarin, un colorant rouge dont la formule brute est C14H8O4. Il calcule le nombre d'insaturation en appliquant la formule : 2 * 14 + 2 - 8 / 2, ce qui donne 11 insaturation. Il explique que les insaturations correspondent aux liaisons doubles ou aux cycles dans la molécule. Il vérifie ensuite la cohérence en comptant les liaisons doubles et les cycles dans la structure moléculaire de l'alizarin, et obtient bien 8 doubles liaisons et 3 cycles, correspondant au nombre d'insaturation calculé précédemment.
Mathis représente ensuite la formule topologique de l'alizarin en indiquant les doubles liaisons, et identifie les groupes caractéristiques de la molécule. Il mentionne la présence de 6 groupes halcènes et de 2 groupes carbonyles associés à la fonction cétone.
En conclusion, Mathis souligne que le nombre d'insaturation est un concept intéressant qui permet de prédire la structure d'une molécule. Il remercie les spectateurs et conclut la vidéo en leur donnant rendez-vous prochainement.
Physique-Chimie
Chimie
Terminale
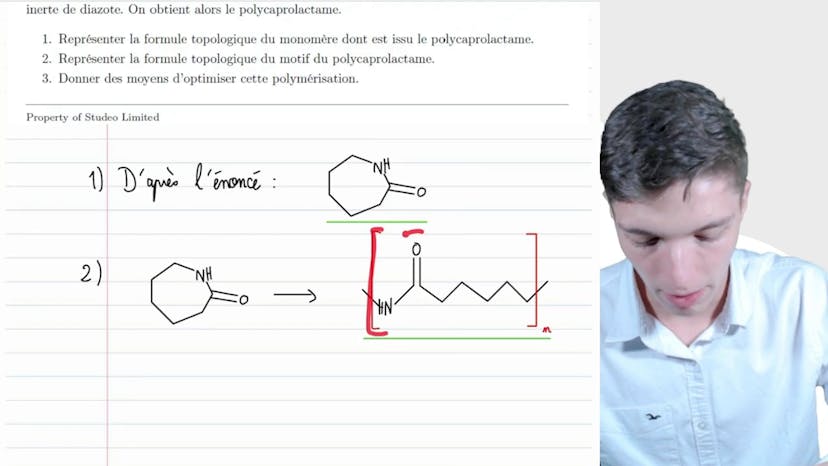
Les lactames
Dans cette vidéo, nous allons nous intéresser à la famille de composés organiques appelés lactames. Les lactames sont caractérisés par la présence d'un groupe amide inclus dans un cycle carboné. Le caprolactame est l'un des composés de cette famille et il est constitué de 7 atomes de carbone dans son cycle, sans autres groupes caractéristiques. Pour obtenir le polycaprolactame, le caprolactame est polymérisé en chaîne par ouverture du cycle au niveau du groupement amide, suivi d'une polycondensation à une température de 269°C et sous atmosphère inerte de diazote. Pour représenter cette transformation, nous pouvons utiliser la formule topologique du monomère, qui montre le groupement amide inclus dans le cycle, ainsi que la formule topologique du polymère, qui illustre l'ouverture du cycle et la chaîne carbonée linéaire. En ce qui concerne les moyens d'optimisation de cette polymérisation, nous pouvons envisager l'utilisation d'un catalyseur, la possibilité de déplacer la réaction si l'un des produits est évacuable, ou l'augmentation de la température pour favoriser la cinétique de la réaction. Merci de nous avoir suivi et à bientôt !
Physique-Chimie
Chimie
Terminale
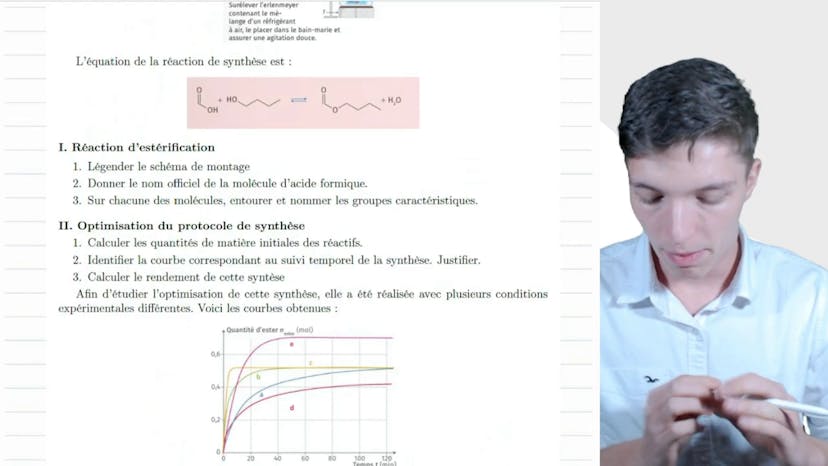
BAC : Estérification
Dans cette vidéo, on aborde la réaction d'estérification. Les esters ont une odeur fruitée et sont utilisés dans l'industrie agroalimentaire et la parfumerie. Certains individus ont une capacité à distinguer les odeurs des esters. En laboratoire, on utilise des méthodes spectroscopiques pour cette réaction.
Le protocole expérimental de cette réaction est illustré par un schéma. On utilise une pipette graduée pour verser le réactif dans l'air laineuse contenant le mélange réactionnel. Le tout est placé dans un bain-marie pour être chauffé et un agitateur magnétique ou mécanique est utilisé pour bien mélanger.
La molécule d'acide formique est l'acide carboxylique utilisé dans cette réaction. Elle est officiellement nommée acide méthanoïque. Les fourmis sécrètent cet acide pour se défendre, d'où son nom.
Dans cette réaction, on identifie différents groupes caractéristiques dans les molécules réactives : le groupement carboxyles, le groupement hydroxyle de l'alcool et le groupement estère.
Pour optimiser cette synthèse, on doit calculer les quantités de matière initiales des réactifs à partir des volumes donnés. On utilise la relation entre la quantité de matière, la masse et le volume pour effectuer ces calculs. On obtient ainsi 0,8 mol d'acide formique et 0,79 mol de butanol.
La courbe correspondant au suivi temporel de la synthèse est identifiée comme étant la courbe C, car les réactifs sont ajoutés à 65°C et dans les proportions stœchiométriques. La quantité d'esters formée, d'après cette courbe, est d'environ 0,5 mol, tandis qu'une réaction totale aurait donné 0,8 mol d'esters. Le rendement de cette synthèse est donc calculé à 63%.
Cet exercice permet de se familiariser avec la réaction d'estérification et ses différentes étapes expérimentales. Il est recommandé de bien comprendre et réviser cet exercice. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

BAC : Détermination d’un protocole
Dans cette vidéo, Matisse de Studio aborde le sujet du protocole de synthèse du méthanoate d'éthyl, qui est utilisé pour donner une odeur de rhum dans l'industrie agroalimentaire. Plusieurs protocoles sont présentés et comparés pour déterminer lequel est le plus optimisé.
Le document 1 présente la réaction de synthèse du méthanoate d'éthyl à partir de l'acide méthanoïque et de l'éthanol. La réaction est lente en l'absence d'un catalyseur.
Les autres documents fournissent des informations sur les propriétés physiques des espèces utilisées, telles que la température d'ébullition et la densité.
Les différents protocoles sont ensuite détaillés. Le protocole 1, qui consiste à mélanger l'éthanol, l'acide méthanoïque et quelques grains de pierre ponce dans un ballon et à chauffer à reflux, ne donne pas de méthanoate d'éthyl. Le protocole 2, qui utilise également de l'acide sulfurique concentré, permet d'obtenir un rendement de 67%. Le protocole 3, qui comprend un excès d'acide méthanoïque, donne des quantités restantes dans le ballon permettant d'évaluer le rendement à 96%. Enfin, le protocole 4, qui utilise un dispositif de chauffage à reflux avec une colonne à distiller, permet d'obtenir un rendement de 97%.
Pour déterminer le protocole idéal, il est nécessaire de comparer les avantages et les inconvénients de chaque protocole en calculant leur rendement respectif. Les protocoles 3 et 4 se révèlent les plus intéressants, avec des rendements de 96% et 97%.
Les comparaisons des protocoles permettent de déduire que l'acide sulfurique concentré est nécessaire comme catalyseur, qu'un excès d'acide méthanoïque améliore le rendement, et que le dispositif de chauffage à reflux utilisé dans le protocole 4 est très efficace.
Finalement, le protocole idéal consiste à réaliser un montage de distillation fractionnée en utilisant 29 mL d'éthanol et 100 mL d'acide méthanoïque. Le milieu est chauffé avec de la pierre-ponce et de l'acide sulfurique concentré, et la température est surveillée. Lorsque la température atteint 55°C et se stabilise, la réaction a évacué le métanoate d'éthyl. Lorsque la température augmente à nouveau, la réaction est stoppée et le distillat contenant le composé recherché est recueilli.
En conclusion, ce cours aborde la façon d'élaborer un protocole de manière optimisée en comparant différents paramètres et en utilisant un critère commun, comme le rendement. L'objectif est d'obtenir le meilleur rendement possible en fonction des critères établis.
Physique-Chimie
Chimie
Terminale

Quantité d’électrons
Dans cette vidéo, nous allons étudier les quantités d'électrons échangés lors d'une réaction électrochimique. La demi-équation électrochimique à la cathode d'un électrolyseur est Al3+ + 3 électrons → Al solide. Nous devons donc écrire la quantité d'électrons transférés, Ne, en fonction de la quantité de matière d'aluminium formée. C'est une question importante en électrochimie, car le courant dépend de ces quantités.
Pour cela, nous pouvons raisonner avec des phrases. Pour chaque atome d'aluminium formé, il y a 3 électrons consommés. Ainsi, la quantité d'électrons consommée est égale à 3 fois la quantité d'aluminium formé. Par exemple, si une mole d'aluminium est formée, 3 moles d'électrons sont consommées.
Ce raisonnement est essentiel à comprendre et nous permettra de résoudre différents exercices. Il est donc utile de se rappeler qu'il est pratique de raisonner avec des phrases. Merci de suivre cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Équation de réaction
Dans cette vidéo, Mathis explique comment écrire une équation de réaction en électrochimie. Il mentionne que lors d'une électrolyse, les réactions électrochimiques aux électrodes sont les suivantes : le nickel solide donne Ni²+ et deux électrons, et le Zn²+ donne Zn solide et deux électrons. Pour écrire l'équation de la réaction d'électrolyse, il faut combiner linéairement les équations de manière à égaler le nombre d'électrons de part et d'autre. On souhaite que dans l'équation finale, il n'y ait pas d'électrons qui interviennent. En sommant les deux équations, on obtient deux électrons de chaque côté, ce qui permet de les supprimer. L'équation finale est donc Ni solide plus Zn²+ est égal à Ni²+ plus Zn solide. Cette équation est parfaitement équilibrée. Peu importe la manière dont on combine linéairement les équations, on obtiendra toujours une équation équilibrée qui décrit la réalité chimique de ce qui se passe dans la pile. Il est important de comprendre qu'il faut combiner linéairement les différentes équations pour compenser le nombre d'électrons produits ou consommés de chaque côté.
Physique-Chimie
Chimie
Terminale

Raisonnement inverse
Dans cette vidéo, on aborde la réaction d'électrolyse d'une solution de chlorure de fer 3 : 2Cl- + 2Fe3+ + eau -> Cl2 + 2Fe2+ + eau. Pour écrire les demi-équations électrochimiques et les couples d'oxydoréduction, on introduit artificiellement un nombre d'électrons. On remarque que la charge varie de 2 lorsqu'on passe d'une espèce à l'autre. Ainsi, on introduit 2 électrons de chaque côté pour équilibrer la charge. On sépare ensuite les deux équations : 2Cl- -> Cl2 + 2e- et 2Fe3+ + 2e- -> 2Fe2+. Simplifiées, les équations deviennent Fe3+ + e- -> Fe2+ et Cl2 + 2e- -> 2Cl-.
Les couples d'oxydoréduction associés sont Fe3+/Fe2+ et Cl2/Cl-. Cette approche inversée de l'électrolyse permet de mieux comprendre les phénomènes chimiques impliqués. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Spontannée ou forcée ?
Dans cette vidéo, Mathis explique comment déterminer si une réaction chimique évolue de manière spontanée ou forcée. Il présente une équation chimique formelle impliquant A, Aq, Bq, CAq et D. La constante d'équilibre à 25°C est de 2,8x10^4 et le quotient de réaction initiale est de 10. Pour déterminer le sens d'évolution de la réaction, il compare le quotient de réaction avec la constante d'équilibre. Si le quotient de réaction est inférieur à la constante d'équilibre, la réaction évolue dans le sens direct, où A et B sont des réactifs pour former C et D. Si le quotient de réaction est supérieur à la constante d'équilibre, la réaction évolue dans le sens inverse, où C et D réagissent pour former A et B. Il est également possible de forcer la réaction à évoluer dans le sens inverse en apportant de l'énergie, comme dans le cas des batteries rechargeables. Cependant, cela nécessite un apport d'énergie, souvent sous forme électrique.
Physique-Chimie
Chimie
Terminale
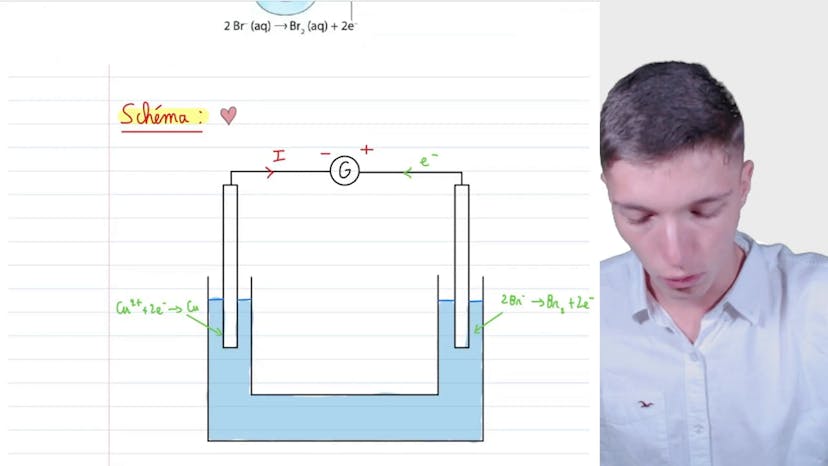
Schéma d’électrolyse
Dans cette vidéo, nous apprenons le schéma classique d'un électrolyseur pour la solution de bromure de cuivre 2. Nous devons recopier et compléter le dispositif relatif à l'électrolyse, en précisant les branchements du générateur, le sens conventionnel du courant et le sens de déplacement des électrons. Les deux électrodes du dispositif sont présentées, avec les réactions qui se produisent à chaque électrode. Le sens de déplacement des électrons peut être déterminé en observant si les électrons sont consommés ou produits à chaque électrode. Dans le cas présent, les électrons sont émis au niveau de l'électrode de gauche et consommés à l'électrode de droite. Le sens de déplacement du courant est donc inverse à celui des électrons. Les branchements du générateur sont indiqués, avec le courant se déplaçant du plus vers le moins. En suivant cette méthodologie, un schéma clair et compréhensif peut être construit pour l'examinateur ou pour le bac. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
Dépôt de cuivre
Aucun résumé n'est disponible pour cette vidéo


