 All subjects
All subjects
 All subjects
All subjects
Physique-Chimie
Chimie
Terminale

Dosage par étalonnage
Dans cette vidéo, Mathis étudie un dosage par étalonnage pour déterminer la concentration d'une solution de permanganate de potassium. La longueur d'onde choisie est de 540 nm, car c'est celle à laquelle le permanganate de potassium absorbe le plus. En utilisant la loi de Berlanbert, Mathis calcule une absorbance théorique d'environ 4,4. Cependant, la gamme de mesures du spectrophotomètre ne couvre pas cette valeur d'absorbance, ce qui rend la mesure imprécise. Pour résoudre ce problème, il propose une dilution de la solution pour abaisser l'absorbance à une valeur mesurable. En divisant la concentration mesurée de la solution diluée par 10, il peut calculer la concentration de la solution mère. Cette méthode est importante à connaître pour les travaux pratiques et a des applications théoriques intéressantes.
Physique-Chimie
Chimie
Terminale

Le diiode
Dans cette vidéo, on étudie une solution de diodes et on cherche à déterminer sa concentration en diodes par étalonnage spectrophotométrique. On effectue des mesures de concentration et d'absorbance à une longueur d'onde optimale de 470 nm. On utilise l'étalonnage pour tracer une droite reliant la concentration à l'absorbance, et ainsi déterminer la loi de l'absorbance en fonction de la concentration. On utilise ensuite cette loi pour trouver la concentration de la solution de diode étudiée, qui a une absorbance de 0,514, en isolant C dans l'équation A x C + B. On obtient une concentration de 564 µmol·L. Il est important de noter le coefficient de régression au carré (R²) pour évaluer la fiabilité de la régression linéaire. Plus il est proche de 1, plus le modèle est fiable. Cette méthode d'étalonnage spectrophotométrique est utile pour doser des espèces qui absorbent du rayonnement et sera suivie d'une méthode de titrage dans une prochaine vidéo.
Physique-Chimie
Chimie
Terminale

Détermination via spectre IR
Dans cette vidéo, on apprend à identifier une molécule à partir de son spectre infrarouge. Le spectre infrarouge est l'empreinte digitale de la molécule, caractérisée par des pics qui représentent les différentes liaisons présentes dans la molécule. On utilise la formule semi-développée pour nommer les trois molécules données en 3D, en repérant les fonctions qu'elles comportent. Ensuite, on analyse le spectre infrarouge pour déterminer à quelle molécule il appartient en repérant les différentes bandes caractéristiques. Par exemple, la bande large et forte vers 3300 cm-1 caractérise une liaison oxygène-hydrogène, et permet d'écarter deux des trois molécules possibles. On déduit finalement que la molécule analysée est du propanol. Il est important de savoir faire la nomenclature et de se référer aux tables de données pour ce type d'exercice.
Physique-Chimie
Chimie
Terminale
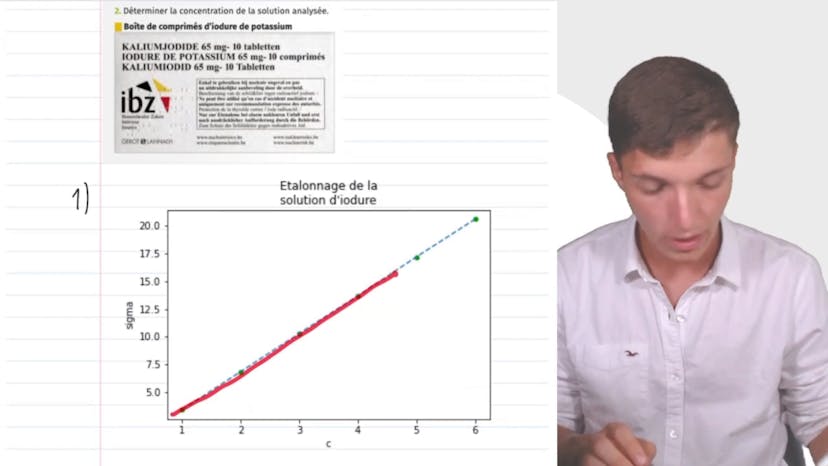
Dosage par étalonnage bis
Dans cette vidéo, Matisse de Studio explique comment effectuer un dosage par étalonnage pour déterminer la concentration d'une solution d'iodure de potassium en mesurant sa conductivité. Il explique comment tracer la courbe de conductivité en fonction de la concentration à l'aide d'un tableur ou sur la calculatrice. Il montre comment déterminer la concentration de la solution analysée en utilisant la courbe de conductivité et la mesure de la conductivité de la solution analysée. Il souligne que cette méthode est utile pour mesurer la concentration de n'importe quelle solution dont la conductivité est située dans la plage de valeurs considérées. Cette méthode est une technique d'étalonnage très précise en mesure thermique.
Physique-Chimie
Chimie
Terminale

Loi de conductivité
Dans cette vidéo, Baptiste de Studio décortique la loi de conductivité en étudiant les différents paramètres qui influent sur la conductance d'une solution. Il explique comment réaliser un dosage par étalonnage conductimétrique en plaçant la solution à analyser sur un support élévateur et en mesurant la valeur de conductivité avec une cellule conductimétrique reliée à un conductimètre. Il n'omet pas d'expliquer la signification des grandeurs S et L qui correspondent respectivement à la surface des plaques de platine de la cellule conductimétrique et à l'écart entre elles. Il calcule ensuite la valeur de la conductance d'une solution à partir de la tension appliquée, du courant mesuré, de la surface des plaques et de la distance entre elles. Il utilise la relation qui relie la conductivité et la conductance pour déterminer la conductivité d'une solution et répond à des questions sur l'évolution de la conductance lorsque la surface des plaques, la distance entre elles ou le volume de la solution varient. Il rappelle que la conductivité et la conductance ne dépendent pas du volume de la solution.
Physique-Chimie
Chimie
Terminale
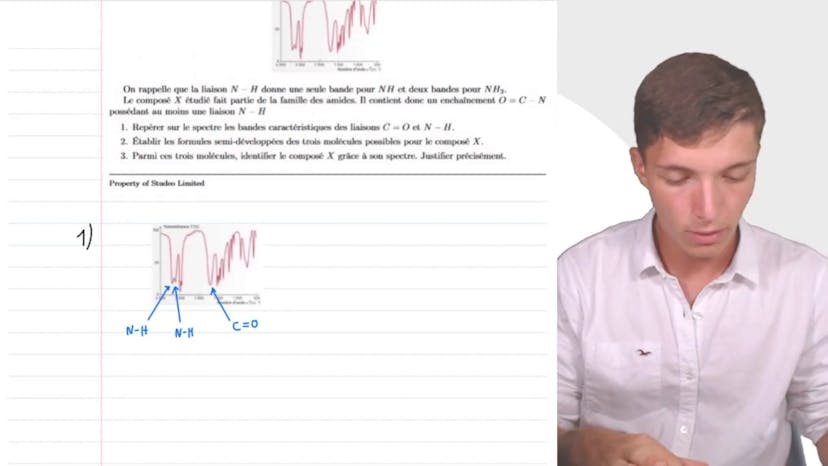
Analyse d'un spectre IR
Dans cette vidéo, nous analysons un spectre IR pour identifier un composé X. Sa formule brute est C3H7NO. Nous savons que la liaison NH donne une seule bande pour NH et deux bandes pour NH2. Étant donné que le composé X est un amide, nous recherchons les bandes caractéristiques des liaisons C, O, N, et H. Sur le spectre, nous observons un pic intense à environ 1700 cm-1, correspondant à la liaison C=O d'un amide. Nous établissons ensuite les formules semi-développées des trois molécules possibles pour le composé X en tenant compte de l'oxygène de liaison C et du seul atome d'azote relié à l'hydrogène. Après avoir complété les structures avec les atomes de carbone et d'hydrogène restants, nous avons trois molécules possibles : propanamide, 2-méthylpropanamide et N-méthyléthanimide. En examinant de plus près le spectre, nous remarquons que le pic correspondant aux liaisons NH est dédoublé, ce qui suggère deux liaisons azote-hydrogène. Parmi les trois molécules possibles, seul le propanamide présente deux liaisons azote-hydrogène. Par conséquent, nous identifions le composé X comme étant le propanamide. La démarche globale et la capacité à identifier les pics sont essentielles pour réussir cet exercice d'interprétation de spectre infrarouge.
Physique-Chimie
Chimie
Terminale

Conductance inconnue
Dans cette vidéo, il est question de déterminer la conductance d'une quatrième solution inconnue en utilisant la conductance de trois autres solutions de même concentration. La conductance est exprimée comme la conductivité de la solution divisée par la constante de cellules de l'appareil de mesure. Il est nécessaire de manipuler les expressions pour déterminer la valeur de la conductance de la quatrième solution en se basant sur les conductances des autres solutions. L'utilisation des expressions de G1, G2 et G3 permet de déterminer que la conductance de la solution inconnue S4 est égale à G1 moins G2 plus G3. La valeur numérique de la conductance de S4 est de 1,12 millisiemens.
Physique-Chimie
Chimie
Terminale
Conductance et avancement
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
Terminale

Chlorure de nickel
Dans cette vidéo, nous étudions l'exercice de détermination de la concentration d'une solution de chlorure de nickel Ni2+, 2Cl- (S1) de trois manières différentes.
La première méthode consiste à mesurer la conductivité de S1, en utilisant la loi de conductivité pour calculer C1, la concentration en soluté. La formule utilisée est σ = λNi2+ * C1 + 2λCl- * C1. En utilisant les valeurs données, nous trouvons que C1 = 3 mol/L.
La deuxième méthode utilise la mesure de l'absorbance de S1 en utilisant la loi de Beer-Lambert, qui est A = ε * L * C. En isolant C1, nous trouvons également une concentration de 3 mol/L.
La troisième méthode implique la réaction de S1 avec l'hydroxyde de sodium NaOH pour former l'hydroxyde de nickel NiOH2 insoluble. En utilisant un tableau d'avancement, nous trouvons les quantités finales de chaque espèce et pouvons calculer la conductance de S1 à l'état final. En isolant C1, nous trouvons encore une fois une concentration de 3 mol/L.
En conclusion, les trois méthodes nous donnent la même concentration de 3 mol/L pour la solution de chlorure de nickel. Cette vidéo est donc un bon exercice pour comprendre la résolution de problèmes de concentration à l'aide de différentes méthodes.
Physique-Chimie
Chimie
Terminale

Salinité des océans
La vidéo traite de la salinité des océans et explique l'importance du programme Argo qui mesure régulièrement la température et la salinité de l'eau à l'aide de 3000 bouées. Pour obtenir une valeur de conductivité fiable, huit mesures consécutives sont nécessaires pour prendre en compte les différentes incertitudes liées à la fiabilité de la sonde, l'homogénéité de l'eau et des événements extérieurs. La deuxième partie de la vidéo explique comment calculer la salinité de l'eau de mer en utilisant la conductivité et la compare à la salinité de l'eau de mer normale qui est de 35 g par kg. En analysant un échantillon de l'océan arctique, la salinité trouvée est inférieure à la salinité de l'eau de mer normale, ce qui peut être dû à des facteurs tels que la température de l'eau mesurée ou la pression atmosphérique. La vidéo montre l'importance du raisonnement scientifique expérimental pour mieux comprendre les différents phénomènes de notre planète Terre.
Physique-Chimie
Chimie
Terminale
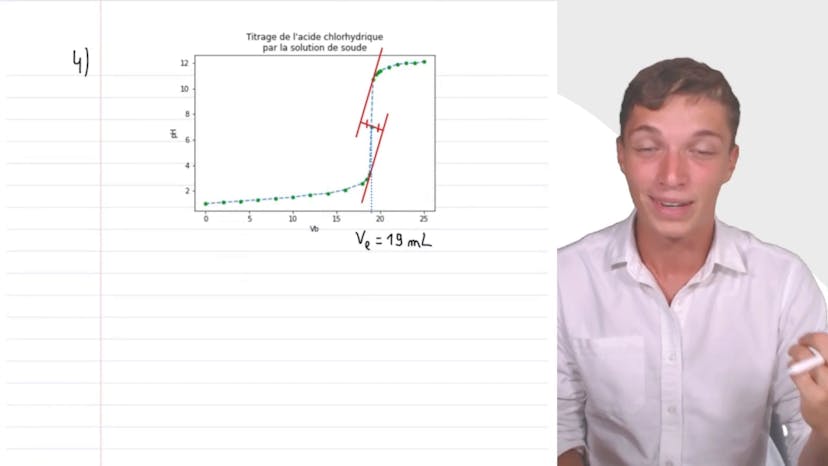
Acide chlorhydrique
Dans cette vidéo de titrage pH métrique de l'acide chlorhydrique, on souhaite vérifier la concentration d'une solution en dosant un volume de 20 millilitres de la solution inconnue avec de la soude Na+ Ho- de concentration Cb=10^-1 mol/L. Le schéma du montage classique présenté comprend un bécher avec un agitateur magnétique, une burette graduée contenant la solution titrante Na+ HO-, et une potence tenant la burette. La réaction acide-base qui se produit dans le bécher est la réaction entre les ions H+ et HO-. Les mesures de pH relevées dans un tableau sont utilisées pour tracer la courbe pH en fonction du volume en utilisant un tableur. La méthode des tangentes est utilisée pour déterminer le volume à l'équivalence, qui vaut 19 millilitres. À l'équivalence, les réactifs sont introduits dans leur proportion stoichiométrique, ce qui signifie que la quantité de réactifs titrés correspond exactement à la quantité de réactifs titrants versée pour réagir complètement. La relation C=CB×V/V est utilisée pour déterminer la concentration de l'acide chlorhydrique, qui est égale à 9,5×10^-2 mol/L. Cette méthode simple et infaillible ouvre la porte à de nombreux exercices en titrage.
Physique-Chimie
Chimie
Terminale

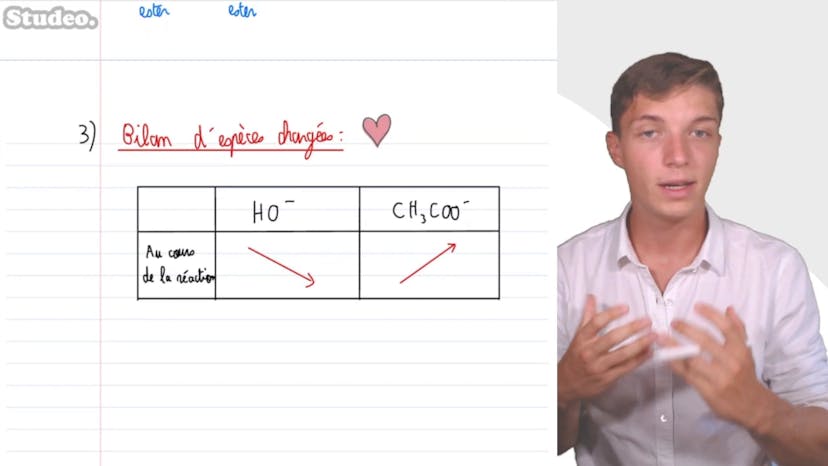
Titrage de l'acide éthanoïque
Dans cette vidéo, Mathis de studio explique comment titrer de l'acide éthanoïque. Pour vérifier la concentration de la solution d'acide éthanoïque, on dose un volume donné d'acide éthanoïque avec une solution de soude de concentration connue. Avant de commencer le dosage, on ajoute de l'eau distillée. On utilise un montage de titrage avec une burette graduée contenant la solution de soude et un bécher contenant la solution d'acide éthanoïque. On place une cellule conductimétrique dans le bécher et la connecte à un conductimètre qui mesure la conductivité de la solution. L'équation de la réaction support du titrage est la réaction entre l'acide éthanoïque et la soude pour former du CH3CO- et de l'eau. Pour déterminer le volume à l'équivalence, il faut analyser la courbe conductimétrique. On utilise un bilan d'espèces chargées pour comprendre l'évolution de la concentration avant et après l'équivalence. Avant l'équivalence, la concentration en H+ est nulle, mais la concentration en CH3CO- augmente. Après l'équivalence, la concentration en CH3CO- reste constante, mais la concentration en H+ augmente. La conductivité augmentera rapidement à l'équivalence. Le volume équivalent est de 8,5 mL. Pour déterminer la concentration en acide éthanoïque, on utilise la relation à l'équivalence selon laquelle les réactifs sont introduits dans leur proportion stoichiometrique. Il est donné que CA*VA = C*VE, donc CA = C*VE/VA. La concentration en acide éthanoïque est de 8,5*10-2 mol/L. Il est important de comprendre comment faire un bilan d'espèces chargées et de tracer les deux périodes de la courbe conductimétrique pour déterminer l'équivalence. C'est une autre approche de titrage qui utilise un suivi conductimétrique.


