All subjects
All subjects
 All subjects
All subjects
Diagramme (P,T)
Dans cette vidéo, nous étudions le diagramme pression-température de l'eau. Nous considérons une masse de 900 g d'eau à la température T1 de 298 Kelvin et à la pression de 1 bar. L'eau subit ensuite un chauffage à pression constante jusqu'à la température T2 de 473 Kelvin, puis une compression à température constante jusqu'à un volume de 100 litres, et enfin une détente à température constante jusqu'à un état d'équilibre liquide-vapeur de volume V4 de 50 litres. Nous tenons compte de la pression à vapeur saturante pour deux températures différentes, de la masse molaire de l'eau et de la constante des gaz parfaits.
Dans l'état 1, nous n'avons pas la pression de vapeur saturante, mais la pression correspond presque à la pression de vapeur saturante pour 373 Kelvin. Cela indique que nous sommes dans un état liquide à 298 Kelvin et dans un état gazeux à 473 Kelvin.
Pour l'état 2, qui correspond à l'état gazeux, nous pouvons utiliser l'équation d'état des gaz parfaits pour déterminer sa pression. En appliquant cette équation avec une masse de 900 grammes et la masse molaire de l'eau donnée, nous trouvons une pression de 20 bars. Nous pouvons alors comparer cette pression à la pression de vapeur saturante et conclure que l'état est liquide.
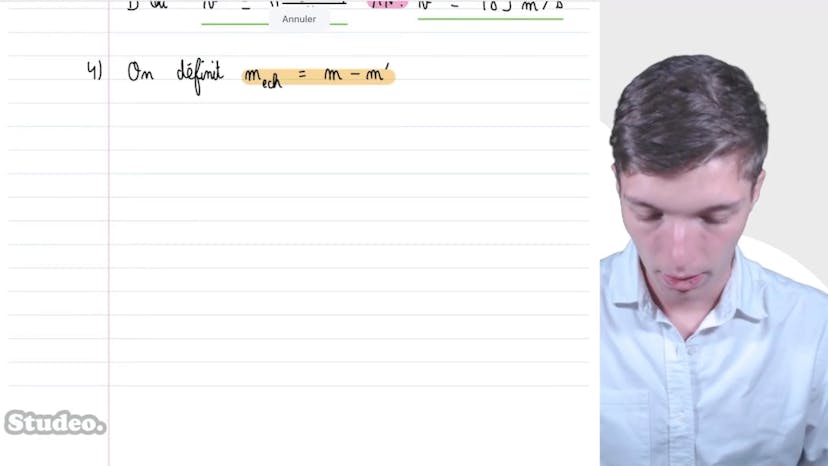
Pour déterminer le titre en vapeur d'eau dans l'état 4, qui est un mélange liquide-gaz, nous utilisons le théorème des moments. En appliquant ce théorème, nous trouvons un titre en vapeur de 49,5%.
Enfin, nous représentons les différentes transformations dans un diagramme pression-température, en passant d'une pression de 1 bar à 298 Kelvin à une pression de 20 bars à 473 Kelvin, avant de revenir sur la courbe de saturation pour le mélange liquide-gaz.
En résumé, cette vidéo explore différentes transformations de l'eau dans un diagramme pression-température. Elle aborde des concepts tels que la pression de vapeur saturante, l'équation d'état des gaz parfaits, le titre en vapeur d'eau et le théorème des moments. N'hésitez pas à revoir cet exercice pour mieux comprendre ces concepts. Merci de nous avoir suivi et à bientôt !