All subjects
All subjects
 All subjects
All subjects
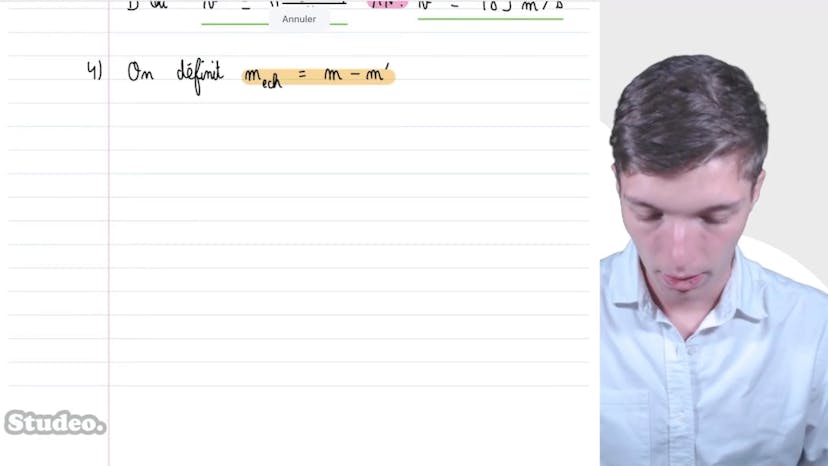
Libre parcourt moyen
Dans cette vidéo, nous abordons la notion de libre parcours moyen, qui concerne la réalité microscopique des molécules. Le libre parcours moyen désigne la distance moyenne qu'une molécule parcourt avant de rencontrer une autre molécule. Pour le dioxygène à pression atmosphérique et à température ambiante, le libre parcours moyen est d'environ 100 nanomètres.
Pour comprendre le libre parcours moyen, nous considérons les molécules comme des sphères indéformables de diamètre d. Une molécule en mouvement entre en collision avec une autre molécule si le centre de la molécule en mouvement se situe à une distance inférieure à d de la trajectoire de la molécule fixe. On peut délimiter un cylindre de base πd² de hauteur L, où L représente le libre parcours moyen.
Nous pouvons définir le libre parcours moyen, L, comme la distance moyenne parcourue par une molécule avant de rencontrer une autre molécule dans ce cylindre. La hauteur limite à laquelle une molécule peut être placée sans entrer en collision est d.
Le libre parcours moyen, L, peut être exprimé en fonction du diamètre des molécules, d, et du nombre de particules par unité de volume, N. En utilisant le nombre d'Avogadro, Na, la constante de Boltzmann, KB, la pression atmosphérique P0 et la température T, nous pouvons obtenir une formule : L = 1/(Na * π * d² * N*).
Pour évaluer la taille des molécules dans le modèle du gaz parfait, nous utilisons la formule précédente et l'équation d'état du gaz parfait (P0 = N * KB * T / V) pour exprimer N en fonction de P0, T et d'autres constantes. Enfin, nous évaluons la taille D des molécules dans le modèle du gaz parfait en utilisant les valeurs numériques correspondantes et obtenons D = 0,36 nanomètre.
En commentant la valeur de D obtenue (0,36 nanomètre) par rapport à la taille d'une molécule de dioxygène (0,29 nanomètre), nous concluons que le modèle du gaz parfait et du libre parcours moyen peuvent décrire assez précisément les molécules de dioxygène. Cependant, il faudrait étudier d'autres molécules pour savoir si cette loi se généralise.