All subjects
All subjects
 All subjects
All subjects
Acide benzoïque (1)
Dans cette vidéo, Théobald de Cydéo présente un exercice de chimie sur la réaction de l'acide benzoïque avec l'eau dans le cadre du BAC de 2022 en Nouvelle-Calédonie. Il explique que l'exercice fait partie des trois exercices au choix et que les étudiants doivent en choisir deux.
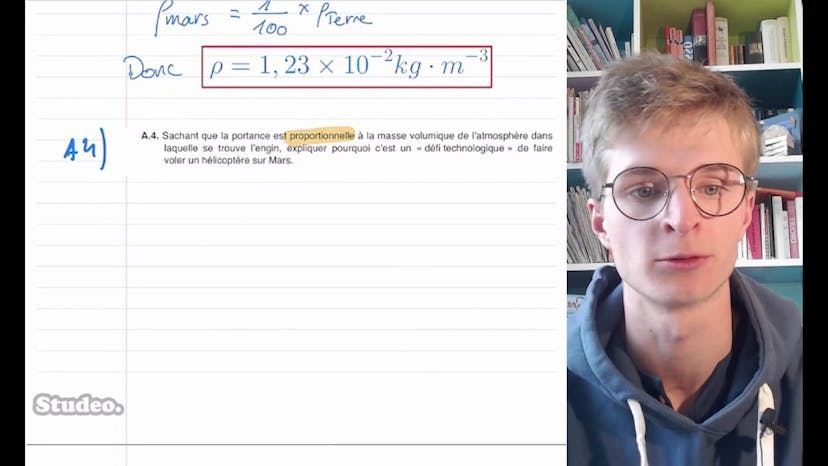
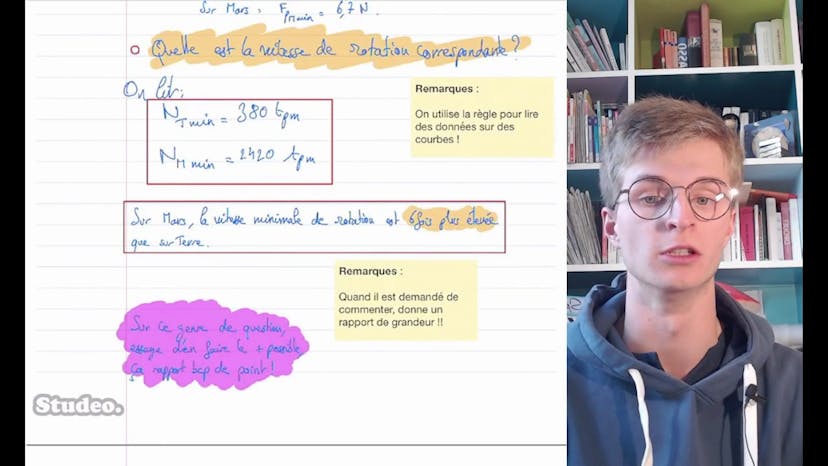
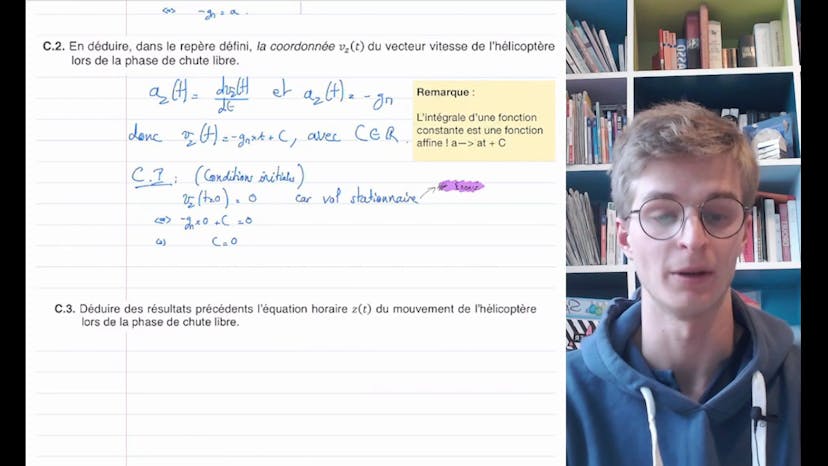
Théobald recommande de survoler les données fournies, qui incluent les valeurs de pK des acides et bases, la solubilité de l'acide benzoïque et la masse molaire des différentes entités chimiques.
La première partie de l'exercice porte sur le calcul de la masse nécessaire pour préparer une solution d'acide benzoïque. Théobald rappelle que la concentration molaire est égale à N/V, avec V en litres et N en moles. En utilisant cette formule, il calcule la quantité de matière correspondant à la masse donnée et en déduit la masse nécessaire pour préparer la solution.
Ensuite, Théobald examine la saturation de la solution. Il explique que la solubilité maximale de l'acide benzoïque est donnée et que la solution est saturée si la concentration d'acide est égale à cette valeur. En vérifiant cette condition, il conclut que la solution n'est pas saturée.
L'équation de réaction de l'acide benzoïque avec l'eau est ensuite écrite. Théobald explique que l'acide réagit avec l'eau pour former l'ion benzoate et l'acide H3O+. Il vérifie que l'équation est équilibrée et que tous les réactifs et produits sont présents.
Théobald procède ensuite à la construction du diagramme de prédominance du couple acide benzoïque/ion benzoate. Il rappelle la relation entre le pH et le pKa et indique que la solution est dans le domaine de prédominance de l'acide, en se référant à la valeur du pH donnée.
Le tableau d'avancement est ensuite complété en fonction des concentrations initiales et finales. Théobald utilise l'équation de réaction pour remplir le tableau et calcule la quantité d'acide restante. L'avancement maximal est également calculé en considérant que tout l'acide a réagi pour former l'ion benzoate.
Enfin, Théobald montre que le taux d'avancement final s'écrit taux = [H3O+] à l'équivalence / C0 en utilisant les valeurs calculées précédemment. Il conclut que le taux d'avancement est faible, ce qui est cohérent avec le fait que la réaction a peu eu lieu.
Théobald termine en proposant de répondre aux questions des spectateurs et annonce qu'il continuera l'exercice dans une autre vidéo.