 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amérique Nord 2
- Centres étrangers 1
- Centres étrangers 2
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amerique Nord 2
- Centres étrangers 1
- Centre étrangers 2
- Polynésie 1
- Polynésie 2
- Métropole 1
- Métropole 2
- Amérique Sud 1
- Amérique Sud 2
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC- Bac Maths
- Bac Physique-Chimie
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amérique Nord 2
- Centres étrangers 1
- Centres étrangers 2
- Asie 1
- Asie 2
- Nouvelle Calédonie 1
- Nouvelle Calédonie 2
- Amérique Nord 1
- Amerique Nord 2
- Centres étrangers 1
- Centre étrangers 2
- Polynésie 1
- Polynésie 2
- Métropole 1
- Métropole 2
- Amérique Sud 1
- Amérique Sud 2
- Bac Maths
- Bac Physique-Chimie
TerminaleMPSI/PCSI Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Corrigés de BAC
Bac Physique-Chimie
Terminale

Le sel d’oseille (1)
Dans cette vidéo, Layla présente le premier exercice d'un sujet de BAC de chimie sur le sel d'oxalate. Elle explique que le sel d'oxalate est une substance chimique sous forme de cristaux blancs et incolores. Sa nomenclature officielle est l'acide oxalique. L'objectif de l'exercice est de valider deux hypothèses sur le type d'acidité de cet acide. On cherche également à connaître son utilisation dans la vie courante.
Dans la première partie de l'exercice, on étudie la première hypothèse selon laquelle l'acide oxalique est un diacide fort. Layla explique la définition d'une espèce acide selon Brønsted, qui peut libérer un proton H+. On peut également avoir affaire à des acides de Lewis, qui sont liés au doublé électronique. L'acide oxalique est un diacide car il peut libérer deux protons H+. Layla présente la représentation de Lewis de l'acide oxalique et explique que les atomes d'hydrogène dans la molécule sont acides en raison de la polarisation de la liaison. Les deux couples acides-bases associés à l'acide oxalique sont donnés, et on souligne la présence d'une espèce amphothère.
Dans la partie expérimentale, Layla explique comment modéliser la transformation chimique entre l'acide oxalique et l'eau en émettant l'hypothèse que c'est un diacide fort. L'équation modélisant cette transformation est présentée, en indiquant que la réaction est totale. On demande ensuite de calculer la concentration en ion hydronium (H3O+) et de déduire le pH théorique de la solution. Layla utilise un tableau d'avancement pour déterminer l'avancement maximal de la réaction et déduire la concentration en H3O+. Finalement, le pH théorique est calculé, mais il est différent du pH expérimental indiqué précédemment. Cela remet en question l'hypothèse selon laquelle l'acide oxalique est un acide fort, car il reste de l'acide à l'état final.
En conclusion, cette première partie de l'exercice remet en cause l'hypothèse selon laquelle l'acide oxalique est un acide fort. La prochaine vidéo abordera l'autre hypothèse selon laquelle c'est un acide faible.
Corrigés de BAC
Bac Physique-Chimie
Terminale
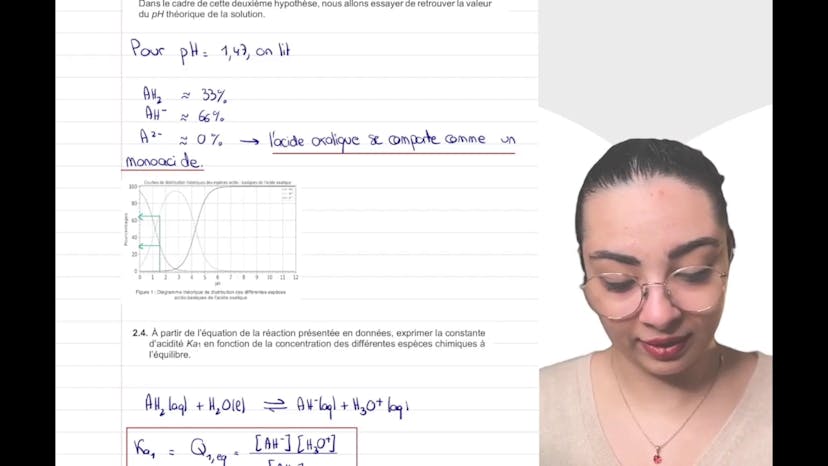
Le sel d’oseille (2)
Le sujet de ce cours porte sur les diacides, en particulier sur l'acide oxalique. Dans une vidéo précédente, on a émis l'hypothèse que l'acide oxalique était un diacide fort, mais cette hypothèse a été invalidée par des expériences détaillées dans la vidéo précédente. Une deuxième hypothèse est donc formulée : l'acide oxalique est considéré comme un monoacide faible en solution. On étudie les concentrations en acide apporté, le pKa (première acidité de l'acide oxalique) et la réaction associée. On rappelle également que le pH de la solution est de 1,47. On demande ensuite d'écrire l'équation modélisée de la transformation de l'espèce AH- avec de l'eau. En utilisant la figure 1, on détermine ensuite le pKa de la deuxième acidité de l'acide oxalique, qui est d'environ 4,3. On utilise ensuite la courbe de distribution théorique pour donner le pourcentage approximatif de chaque espèce présente dans la solution. On constate que seule la forme AH2 et AH- sont présentes, tandis que la forme A2- est négligeable. On peut donc considérer que l'acide oxalique se comporte comme un monoacide faible. On passe ensuite à l'aspect théorique en exprimant la constante d'acidité K1 en fonction des concentrations des espèces à l'équilibre. On introduit également l'équation du second degré et on utilise un code Python pour calculer la concentration en oxonium (H3O+). Ce code Python résout l'équation du second degré et donne un pH final très proche de la valeur expérimentale. On conclut en validant l'hypothèse que l'acide oxalique se comporte comme un monoacide faible. Dans la prochaine vidéo, on abordera la partie 3 de cet exercice.
Corrigés de BAC
Bac Physique-Chimie
Terminale
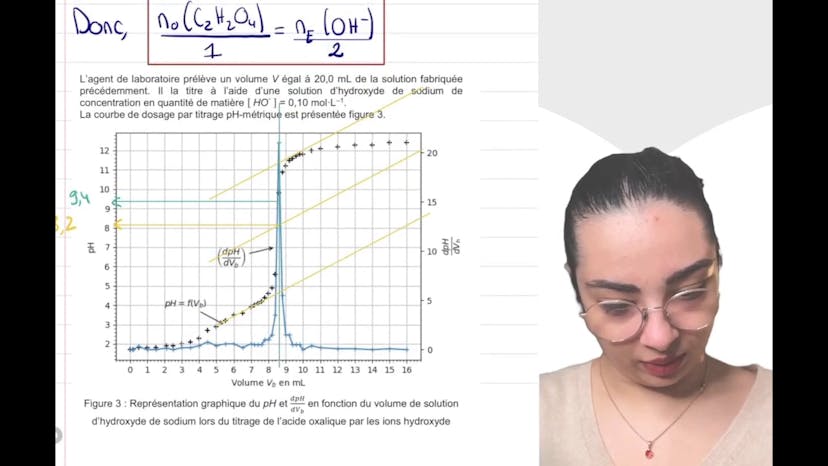
Le sel d’oseille (3)
Le cours porte sur l'acide oxalique et ses différentes formes (pure et hydratée). Le problème à résoudre est de déterminer si un solide blanc trouvé dans un récipient contient de l'acide oxalique hydraté ou pur. Pour cela, un titrage par suivi pH métrique est effectué sur une solution aqueuse.
Dans un premier temps, la concentration massique de la solution est calculée en prenant en compte les conditions expérimentales et leur incertitude. L'équation support du titrage est donnée pour trouver cette concentration.
La justifications du coefficient 2 devant l'ion hydroxyde de l'équation de la réaction est expliquée en considérant que l'acide oxalique est un diacide qui nécessite deux ions H+ pour réagir.
Afin d'utiliser un dosage par titrage direct, il est nécessaire que la transformation chimique soit unique, totale et rapide. D'autres méthodes expérimentales peuvent également être utilisées pour déterminer les concentrations.
La relation entre les quantités de matière en espèce titrée et titrante à l'équivalence est donnée par la proportion stoichiométrique des réactifs.
Pour déterminer le pH à l'équivalence, deux méthodes sont présentées. La première consiste à observer le pic de la dérivée de la courbe de pH en fonction du volume. La seconde utilise la méthode des tangentes pour trouver le pH au point médian entre les deux tangentes tracées. Selon ces méthodes, les valeurs de pH à l'équivalence sont respectivement de 9,2 et 8,2.
En choisissant un indicateur coloré, il est préférable de prendre en compte les deux sauts de pH observés. La phénolphthaleine est recommandée car elle couvre les deux domaines de changement de couleur.
Finalement, en utilisant les résultats du titrage, la concentration en quantité de matière d'acide oxalique est déterminée, puis on peut conclure si l'acide est hydraté ou non. En comparant la concentration massique obtenue avec les valeurs fournies au début de l'exercice, on peut conclure que l'acide oxalique est hydraté.
Il est recommandé d'exploiter les résultats du titrage et de considérer les concentrations massiques pour répondre aux questions sur l'hydratation de l'acide oxalique.
Corrigés de BAC
Bac Physique-Chimie
Terminale
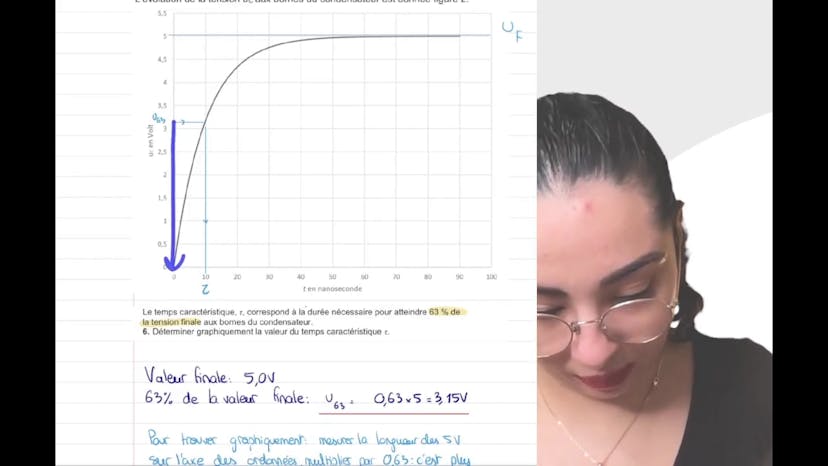
Un capteur capacitif
Dans ce cours, nous étudions l'exercice d'électricité sur le capteur capacitif qui est tombé au bac l'année dernière. Nous commençons par l'étude théorique de la charge d'un dipôle RC en utilisant la loi des mailles et la loi d'Ohm. Ensuite, nous établissons l'expression reliant le courant d'intensité I, la tension UC et la capacité C du condensateur. En utilisant ces relations, nous pouvons déterminer l'équation différentielle qui régit l'évolution de la tension UC au borne du condensateur. Nous passons ensuite à l'étude expérimentale de la charge en utilisant un montage avec une résistance donnée. Nous déterminons graphiquement le temps caractéristique tau et calculons la valeur de la capacité C du condensateur. Ensuite, nous nous intéressons au condensateur à capacité variable et décrivons son évolution si on rapproche l'armature mobile de l'armature fixe. Enfin, nous expliquons comment utiliser ce montage pour contrôler l'épaisseur d'une colle en mesurant la capacité du condensateur.
Corrigés de BAC
Bac Physique-Chimie
Terminale

La planète mercure
Dans cet exercice, nous étudions la planète Mercure et la sonde Messenger. La première partie concerne la trajectoire de Mercure et nous rappelle la première loi de Kepler, selon laquelle l'orbite de chaque planète est une ellipse dont un des foyers est le Soleil. Nous devons calculer le demi-grand axe de l'orbite de Mercure, en utilisant les informations fournies sur la distance au Soleil (0,31 à 0,47 UA).
Ensuite, nous devons appliquer la deuxième loi de Kepler, selon laquelle une planète balaie des aires égales pendant des durées égales. Nous devons déterminer dans quelle partie de sa trajectoire Venus atteint la vitesse de 39 km par seconde. Nous pouvons le déterminer en observant la taille des aires balayées par Mercure à différents endroits de son orbite.
Enfin, nous examinons la trajectoire de la sonde Messenger autour de Mercure. Nous devons appliquer le principe fondamental de la dynamique en utilisant l'expression de la force gravitationnelle et les données fournies sur la période de révolution de la sonde (8 heures) et l'altitude au plus près de la surface (200 km). Nous pouvons ensuite isoler la masse de Mercure en utilisant l'accélération mesurée.
En appliquant les lois de Kepler au mouvement de la sonde Messenger, nous pouvons calculer la valeur du demi-grand axe de l'orbite et comparer cela à la réalité. Nous constatons que la trajectoire de la sonde n'est pas circulaire, ce qui explique pourquoi le demi-grand axe est plus grand que la somme du rayon de Mercure et de l'altitude de la sonde.
Cet exercice nous permet d'étudier la gravitation, les lois de Kepler et le principe fondamental de la dynamique.
Corrigés de BAC
Bac Physique-Chimie
Terminale

Nos oreilles, on y tient !
Dans ce cours, Layla aborde un exercice d'acoustique portant sur l'audition et les niveaux sonores. Elle utilise les formules liées aux décibels pour analyser si certaines activités peuvent être nocives pour l'audition. Layla explique que le niveau d'intensité sonore est exprimé en décibels, allant jusqu'à 120 dB, et que la limite de nocivité est située au-dessus de 85 décibels. Elle utilise la formule L = log(I/I0) pour étudier différentes situations et déterminer si le niveau sonore est nuisible pour la santé.
Dans la première situation, Layla décrit deux conducteurs séparés par une distance D2, avec un autoradio dans la première voiture. Les deux véhicules ont les fenêtres baissées. Layla utilise le modèle géométrique d'atténuation sonore pour expliquer que plus on est loin de la source sonore, plus l'intensité sonore est faible. Elle utilise ensuite les formules pour calculer l'intensité sonore reçue par le conducteur 1 (I1) en fonction de la puissance sonore (P) et des distances D1 et D2. Elle explique également comment calculer l'atténuation géométrique entre les deux conducteurs (AGO) en utilisant les niveaux sonores mesurés.
Layla passe ensuite à l'analyse expérimentale de la situation, où les conducteurs mesurent les niveaux sonores avec un sonomètre. Elle explique comment calculer l'atténuation expérimentale à partir des niveaux mesurés (L1 et L2) en utilisant la formule L1 - L2.
Dans la deuxième partie, Layla étudie ce qui se produit lorsque les fenêtres des voitures sont fermées. Elle explique que cela entraîne une atténuation supplémentaire due à l'absorption du son par les vitres. Elle utilise les formules pour calculer cette atténuation supplémentaire en ajoutant l'atténuation géométrique (AGO) à l'atténuation due aux fenêtres (Afenêtre). Layla compare ensuite le niveau sonore mesuré par le conducteur 1 avec la limite de nocivité pour déterminer si le conducteur est exposé à un niveau sonore dangereux.
En résumé, ce cours aborde l'atténuation sonore et analyse différentes situations pour déterminer si les niveaux sonores sont nocifs pour l'audition. Layla utilise des formules et des calculs pour étudier l'atténuation géométrique et l'atténuation due aux fenêtres des voitures.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Le sel d’oseille (1)
Dans ce cours, Layla de Studéo présente le premier exercice d'un sujet de BAC de chimie sur le sel d'osaïe. Elle commence par expliquer que le sel d'osaïe est en réalité l'acide oxalique, une substance chimique utilisée dans de nombreuses synthèses. L'objectif de l'exercice est de déterminer si l'acide oxalique est un acide fort ou un acide faible.
Layla explique ensuite la définition d'une espèce acide selon Brønsted, qui libère un proton H+, et d'une base de Brønsted, qui capte un proton H+. Elle mentionne également les acides de Lewis, liés au doublé électronique.
Elle poursuit en montrant la représentation de Lewis de l'acide oxalique et en expliquant pourquoi il est considéré comme un diacide, capable de libérer deux protons H+. Elle donne également les deux couples acides-bases associés à l'acide oxalique.
Dans la partie expérimentale, Layla modélise la transformation chimique entre l'acide oxalique et l'eau en supposant que c'est un diacide fort. Elle écrit l'équation de la réaction et utilise un tableau d'avancement pour déduire la concentration en H3O+. Elle trouve une concentration de 1*10^-1 mol par litre.
En comparant le pH théorique calculé à partir de la concentration en H3O+ avec le pH expérimental, Layla conclut que l'hypothèse selon laquelle l'acide oxalique est un acide fort n'est pas valide. En effet, la solution est moins acide que prévu, ce qui indique une réaction incomplète et donc, que l'acide oxalique est un acide faible.
Layla annonce ensuite qu'elle étudiera cette autre hypothèse dans une prochaine vidéo.
Résumé : Layla de Studéo présente le premier exercice d'un sujet de BAC de chimie sur l'acide oxalique. Elle explique les concepts de base et utilise un tableau d'avancement pour déterminer si l'acide oxalique est un acide fort ou faible. Elle conclut que c'est un acide faible.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Le sel d’oseille (2)
Dans cette vidéo, nous terminons le sujet sur les diacides qui est tombé l'année dernière en Polynésie dans l'exercice sur les sels d'ozaïque. Dans la vidéo précédente, nous avons étudié l'acide oxalique et avons invalidé l'hypothèse selon laquelle il s'agirait d'un diacide fort. Nous formulons donc une nouvelle hypothèse selon laquelle l'acide oxalique est en réalité un monoacide faible en solution.
Nous donnons les concentrations d'acide apporté et son pKa, ainsi que la réaction associée. Nous remarquons que cette réaction présente des doubles flèches, ce qui indique qu'il s'agit d'une dissociation partielle en équilibre. Nous rappelons que le pH de la solution réalisée est de 1,47, ce qui servira de preuve pour valider ou invalider notre hypothèse.
Nous devons également écrire l'équation modélisée de la transformation chimique de l'espèce AH- avec l'eau. Cette réaction est classique et produit un proton et une forme hydratée (H3O+).
En utilisant la figure 1, nous déterminons le pKa de la deuxième acidité de l'acide oxalique. En nous plaçant au point d'intersection de la courbe de distribution théorique, nous trouvons un pH égal à environ 4,3, ce qui correspond au pKa recherché.
En utilisant la figure du pH réel, nous donnons une estimation approximative du pourcentage de chaque espèce présente dans la solution. Nous constatons que la concentration de A2- est négligeable et pouvons donc considérer que l'acide oxalique se comporte comme un monoacide.
Nous exprimons ensuite la constante d'acidité K1 en fonction des concentrations des espèces à l'équilibre. Nous utilisons le quotient réactionnel de la réaction et l'activité de l'eau pour cela.
Nous devons également justifier la concentration en oxonium notée H et vérifier une équation du second degré donnée. En utilisant un tableau d'avancement, nous exprimons les concentrations de chaque espèce en fonction de H et utilisons la constante de réaction KA1 pour établir l'équation du second degré.
Enfin, nous utilisons un code Python pour calculer la valeur de KA1 et constatons que le pH final calculé est très proche du pH expérimental, ce qui confirme notre hypothèse selon laquelle l'acide oxalique se comporte comme un monoacide faible.
En conclusion, cette vidéo nous a permis de terminer notre étude sur les diacides et de valider l'hypothèse selon laquelle l'acide oxalique se comporte comme un monoacide faible.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Le sel d’oseille (3)
Ce cours concerne l'étude de l'acide oxalique et de ses réactions. On cherche à déterminer si un solide est de forme pure ou hydratée grâce à un titrage par suivi pH métrique. On calcule d'abord la concentration massique avec ses incertitudes. Ensuite, on justifie le coefficient 2 devant l'ion hydroxyde dans l'équation de réaction, en se basant sur le fait que l'acide oxalique est un diacide. On explique également les conditions nécessaires pour utiliser un titrage direct. On donne ensuite la relation entre les quantités de matière en espèce titrée et titrante à l'équivalence. On détermine le pH à l'équivalence en utilisant soit la dérivée de la courbe pH-volume, soit la méthode des tangentes. On choisit un indicateur coloré qui couvre les deux sauts de pH. En utilisant le résultat du titrage, on calcule la concentration en quantité de matière en acide oxalique et on détermine s'il est hydraté ou non. On compare les concentrations massiques et on conclut que l'acide oxalique est hydraté. Le lien entre les concentrations massiques et la détermination de l'hydratation a été réalisé grâce à l'aspect prise d'initiative. Ce cours peut être complété par d'autres vidéos traitant des exercices de physique A, B et C.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Un capteur capacitif
Le cours est une transcription d'une vidéo qui explique un exercice d'électricité sur le capteur capacitif. Le but de l'exercice est d'étudier un dipôle RC en établissant une équation différentielle et en conduisant une étude théorique et expérimentale de la charge. Les principales formules utilisées sont la loi des mailles, la loi d'Ohm et la relation entre le courant d'intensité, la tension aux bornes du condensateur et la capacité du condensateur. Ensuite, la vidéo explique comment déterminer graphiquement la durée nécessaire pour atteindre 63% de la tension finale aux bornes du condensateur et comment calculer la valeur de la capacité C du condensateur. Elle aborde également l'utilisation d'un condensateur à capacité variable et explique comment cela peut être utilisé pour contrôler l'épaisseur d'une colle.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

La planète mercure
Aujourd'hui, nous allons aborder l'exercice B du sujet Polynésie de 1022 jour 2, qui porte sur la planète Mercure et notamment sur les concepts de force centrale, études de trajectoire, loi de Kepler, loi de Newton, gravitation, etc. On nous présente tout d'abord des informations sur la planète Mercure, qui est mal connue et proche du Soleil. Sa distance au Soleil varie entre 0.31 et 0.47 UA, et sa vitesse orbitale est de 47 km par seconde. En utilisant un schéma d'une ellipse, on montre que le demi-grand axe de l'orbite de Mercure vaut 0,39 UA. Nous énonçons ensuite la deuxième loi de Kepler, appelée loi des aires, qui stipule qu'une planète balaie des aires égales pendant des durées égales, et nous l'appliquons pour déterminer à quel endroit de sa trajectoire Venus atteint la vitesse de 39 km par seconde. Par la suite, en utilisant les données pertinentes et la troisième loi de Kepler, nous expliquons que Mercure parcourt l'ensemble de son orbite en un peu moins de trois mois. Nous passons ensuite à l'étude de la trajectoire de la sonde Messenger, qui a une période de révolution de 8 heures et une altitude de 200 km. En utilisant les lois de la gravitation et le principe fondamental de la dynamique, nous montrons que l'accélération mesurée à cette altitude permet d'attribuer à Mercure une masse de 3,29 × 10^23 kg. Enfin, nous appliquons la troisième loi de Kepler à la sonde Messenger pour calculer la valeur du demi-grand axe de son orbite, et nous expliquons pourquoi sa trajectoire ne peut pas être considérée comme circulaire. En résumé, cet exercice couvre les concepts de la planète Mercure, des lois de Kepler, de la gravitation et du principe fondamental de la dynamique.
Corrigés de BAC
Bac Physique-Chimie
MPSI/PCSI

Nos oreilles, on y tient !
Dans ce cours, Layla explique un exercice d'acoustique qui porte sur l'audition et le niveau sonore. Elle utilise des formules qui portent sur les décibels pour déterminer si certaines activités peuvent être nocives pour l'audition. Elle décrit la situation où deux conducteurs sont séparés par une distance et où un autoradio est allumé dans la première voiture. Les fenêtres des deux voitures sont baissées. Layla utilise la formule d'atténuation géométrique pour calculer l'intensité sonore reçue par le conducteur 1 et le conducteur 2. Elle détermine ensuite que l'atténuation géométrique est égale à 9,8 décibels. Layla mesure ensuite le niveau d'intensité sonore avec un sonomètre et trouve un niveau inférieur à celui théorique, ce qui est cohérent. Elle calcule ensuite l'incertitude type de cette atténuation et trouve que l'atténuation est compatible avec les mesures expérimentales. Ensuite, Layla étudie ce qui se passe lorsque les fenêtres sont fermées et explique que cela entraîne une atténuation par absorption. Elle utilise cette information pour déterminer si le conducteur 1 est exposé à un niveau d'intensité sonore supérieur à la limite de nocivité. Elle conclut en disant que le conducteur 1 est effectivement exposé à un niveau sonore supérieur à la limite de nocivité. Le cours est donc centré sur l'atténuation sonore et l'impact sur la santé auditive.


