 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
MPSI/PCSI
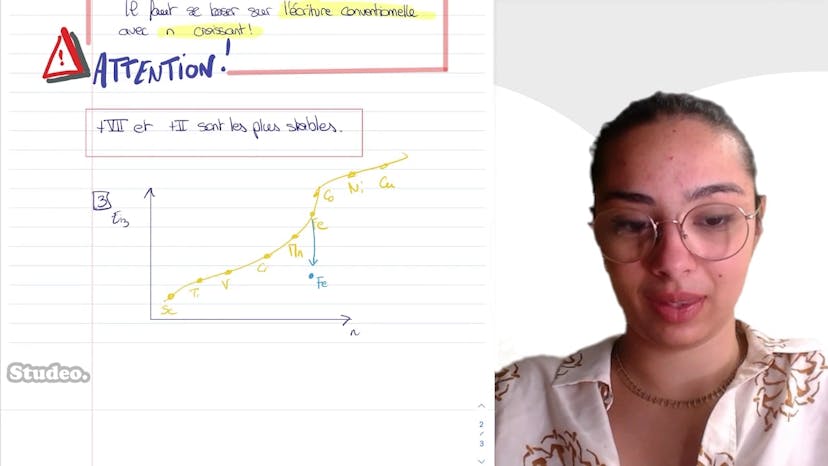
Autour du manganèse
Le cours porte sur le manganèse et aborde les sujets des configurations électroniques, des énergies de ionisation et de la classification périodique. La structure électronique fondamentale de l'atome de manganèse est 1s², 2s², 2p6, 3s², 3p6, 4s² et 3d5. L'élément appartient au bloc D de la classification périodique en raison de la sous-couche D en cours de remplissage. Les degrés d'oxydation accessibles au manganèse sont de 1 à 7, car il a 7 électrons de valence. Les degrés d'oxydation les plus stables pour le manganèse sont +2 et +7. Les énergies de troisième ionisation de certains éléments de la période du manganèse sont discutées, avec un écart particulièrement élevé pour le fer en raison de sa sous-couche D semi-remplie. Il est également souligné que lors de la formation d'ions, les électrons sont enlevés dans l'ordre croissant des niveaux d'énergie.
Physique-Chimie
Chimie
MPSI/PCSI
Représentation de Lewis
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
MPSI/PCSI

Chlorure d'hydrogène
Dans cette vidéo, nous allons étudier le chlorure d'hydrogène (HCl) à travers sa représentation de Lewis. Pour représenter une molécule avec le format de Lewis, nous devons d'abord établir les configurations électroniques des atomes. L'hydrogène a un électron de valence (1s1) et le chlore a 7 électrons de valence (1s2, 2s2, 2p6, 3s2, 3p5). Nous plaçons ensuite des doublés autour de la molécule pour satisfaire la règle de l'octet. Dans le cas du chlorure d'hydrogène, nous plaçons une liaison simple entre H et Cl et trois doublés sur le chlore pour compenser les 7 électrons de valence. Les atomes sont neutres. Ensuite, nous calculons le moment dipolaire théorique de la liaison en supposant qu'elle est purement ionique. Le moment dipolaire est calculé à l'aide de la formule deltaED, où delta est le pourcentage ionique, E est la charge élémentaire et D est la distance entre les atomes. Si la liaison était purement ionique, le pourcentage delta serait de 1. En utilisant cette formule, nous pouvons calculer le moment dipolaire théorique, qui est de 6,11 Debye. Le pourcentage ionique de la liaison HCl est alors calculé en utilisant le moment dipolaire expérimental et le moment dipolaire théorique. Dans le cas du chlorure d'hydrogène, le pourcentage ionique est de 17,5%, ce qui indique une liaison plutôt covalente. Le moment dipolaire est une grandeur importante en chimie pour déterminer les caractéristiques du solvant utilisé. En conclusion, nous devons retenir comment établir la formule de Lewis et comment représenter le moment dipolaire, ainsi que sa formule.
Physique-Chimie
Chimie
MPSI/PCSI
Formes mésomères
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
MPSI/PCSI

Aniline
Dans cette vidéo, nous étudions l'aniline, une molécule avec la formule C6H5NH2. Nous commençons par la formule de Lewis, qui est un cycle aromatique de 6 carbones avec des doubles liaisons et un groupe amine attaché à l'un des carbones. Cette formule permet de générer des formules mesomères. Nous observons un doublet non-liant qui peut se mettre à côté de la liaison carbone-azote, créant ainsi une formule avec l'azote chargé positivement et le carbone chargé négativement. Bien que cette formule soit statistiquement moins probable en raison des charges formelles, elle reste une possibilité. Ensuite, nous remarquons un autre doublet non-liant qui peut se délocaliser sur la liaison simple entre deux carbones, créant ainsi une nouvelle formule avec la charge déplacée sur le dernier carbone. Ce processus peut être répété pour créer d'autres formes mesomères possibles pour l'aniline. Les quatre formules mesomères les plus courantes pour l'aniline sont présentées. Par la suite, nous abordons la structure de l'hybride de résonance correspondant, qui est une combinaison des différentes formes mesomères. Il est important de comprendre la délocalisation des doubles liaisons lors de la résonance par mesomérie. Merci d'avoir suivi cette vidéo et à bientôt.
Physique-Chimie
Chimie
MPSI/PCSI
VSEPR
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
MPSI/PCSI
Evolution d'un angle
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
MPSI/PCSI
Radicaux
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
MPSI/PCSI

Autour de l'iode
Dans cette vidéo, Mathis explique la géométrie des molécules contenant de l'iode. Il commence par donner la représentation de Lewis des ions triodure (I3-) et triodonium (I3+), où l'atome central est lié à chaque voisin par une liaison simple.
Pour le triodure (I3-), l'étude précédente nous montre qu'il a une forme linéaire. En utilisant la méthode VSEPR, on peut déterminer que sa géométrie est AX2E3. En représentant cette molécule dans l'espace, on place les doubles liens dans le plan et on obtient une molécule linéaire.
Pour le triodonium (I3+), l'atome d'iode a perdu un doublet d'électrons, ce qui rend chaque iode conforme à la règle de l'octet. Sa géométrie, selon la méthode VSEPR, est AX2E2, similaire à la molécule coudée H2O. En représentant cette molécule dans l'espace, on observe une structure coudée avec un angle inférieur à 109,5 degrés.
Ensuite, Mathis aborde la représentation de Lewis de l'ion IO3-, où l'atome d'iode est central. Bien que les liaisons iode-oxygène puissent sembler avoir des longueurs différentes en raison de la présence d'une liaison double, il faut prendre en compte la mésomérie. En utilisant des formules mesomères équivalentes, on conclut que toutes les liaisons I-O sont équivalentes.
Il passe ensuite à la géométrie de cet ion selon la méthode VSEPR. Étant donné qu'il est lié à trois atomes différents et possède un doublet libre, sa géométrie est AX3E1, une pyramide à base triangulaire.
Enfin, Mathis donne la représentation de Lewis de la molécule IBR5, avec l'atome d'iode comme atome central. Il utilise tous les électrons de valence de l'iode, à l'exception de deux, pour lier cinq atomes de brome autour. Il conclut que les molécules FCL5, avec l'atome de fluor central, et BRCL5, avec l'atome de brome central, ne peuvent pas exister en raison des contraintes d'octet et d'électronégativité.
En résumé, cette vidéo traite de différentes notions de géométrie moléculaire en utilisant les méthodes de représentation de Lewis et VSEPR. Elle souligne l'importance de prendre en compte la mésomérie pour comprendre les longueurs de liaison et met en évidence les contraintes d'octet et d'électronégativité dans la formation de certaines molécules.
Physique-Chimie
Chimie
MPSI/PCSI

(Per)manganate
Dans cette vidéo, Matisse de Studio aborde les ions permanganate et manganate. Il commence par expliquer comment trouver la représentation de Lewis prépondérante de ces ions en se basant sur la configuration électronique du manganèse. En utilisant la configuration électronique (3s², 3p⁶, 4s², 3d⁵), il détermine qu'il y a 7 électrons de valence. En plaçant le manganèse au centre, avec les oxygènes répartis autour à l'aide d'une liaison simple, il parvient à obtenir la formule de Lewis pour le permanganate (MnO4-). Il explique également que lorsque l'on ajoute un électron supplémentaire pour obtenir du manganate (MnO4²-), la structure reste tétrahédrique.
Dans la deuxième partie de la vidéo, Matisse aborde la différence de distance MnO dans les deux ions. Il explique que cela est dû au caractère plus ou moins marqué de la double liaison. Grâce à la résonance de mesomérie, les liaisons MnO dans le manganate sont plus proches de la liaison simple que dans le permanganate. Cela est dû au fait que l'addition de l'électron cibataire dans le manganate réduit le nombre de doubles liaisons. Par conséquent, les liaisons simples sont plus grandes que les doubles liaisons. Ainsi, les liaisons dans le manganate sont globalement plus grandes que dans le permanganate.
En conclusion, cette vidéo explore de manière approfondie la façon dont la résonance de mesomérie affecte les longueurs de liaison dans les ions permanganate et manganate.
Physique-Chimie
Chimie
MPSI/PCSI

Monoxyde de carbone
Dans cette vidéo, Mathis du Studio aborde le sujet du monoxyde de carbone. Il commence par expliquer que l'oxygène et le carbone peuvent se combiner pour former le monoxyde de carbone. Il répond ensuite à la première question qui consiste à donner la formule de Lewis du monoxyde de carbone, en précisant les charges formelles. Il explique qu'il existe une seule forme dans laquelle tous les atomes vérifient la règle de l'octet, avec une triple liaison entre le carbone et l'oxygène. Il mentionne que le carbone a une charge négative tandis que l'oxygène a une charge positive.
Ensuite, il aborde la notion d'électronégativité d'un élément, qui mesure sa capacité à attirer des charges négatives. Il explique que selon l'échelle de Pauling, l'oxygène est plus électronégatif que le carbone. Il conclut que les charges formelles sont en désaccord avec les électronégativités des atomes, ce qui est un résultat classique.
Par la suite, il calcule la norme du moment dipolaire du monoxyde de carbone en utilisant une formule donnée précédemment. Il explique que la valeur obtenue est exprimée en deux bails, une unité pratique pour manipuler les chiffres de l'ordre de l'unité.
Enfin, il évalue le moment dipolaire théorique si la liaison CO était parfaitement ionique. Il calcule ensuite le pourcentage ionique de la liaison CO, en comparant le moment dipolaire expérimental avec celui théorique. Il conclut que la liaison est très peu ionique et comporte un fort caractère covalent, ce qui est cohérent avec la structure de Lewis.
Il termine la vidéo en remerciant les spectateurs et en soulignant l'importance de la structure de Lewis dans l'étude chimique des composés.
Physique-Chimie
Chimie
MPSI/PCSI

Température d'ébullition
Dans cette vidéo, nous étudions le lien entre les interactions moléculaires et la température d'ébullition de certains composés. Nous comparons les propriétés du propane, de l'éthanamine et de l'éthanol, notamment leur masse molaire, leur moment dipolaire et leur température d'ébullition. Pour interpréter ces températures, il faut comprendre la notion d'ébullition, qui correspond au passage de l'état liquide à l'état gazeux. Cela nécessite de rompre les liaisons entre les molécules, ce qui demande de l'énergie. Plus les interactions entre les molécules sont fortes, plus il faudra d'énergie pour les rompre, ce qui se traduit par une température d'ébullition plus élevée. Nous nous intéressons aux interactions de type Van der Waals, en particulier les interactions de London et les liaisons hydrogènes. Le propane, une molécule apolaire, présente des interactions faibles de London, ce qui lui confère une faible température d'ébullition. L'éthanamine, une molécule polaire avec des liaisons hydrogènes, nécessite plus d'énergie pour rompre ces interactions et a donc une température d'ébullition plus élevée. L'éthanol, avec un moment dipolaire encore plus important et des interactions de quissomme plus fortes, a la température d'ébullition la plus élevée. Il est important de tenir compte de ces caractéristiques moléculaires lors de l'analyse des températures d'ébullition.


