 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
Terminale

Eau minérale
Dans cette vidéo, on étudie une eau minérale en mesurant son pH et sa concentration en ion calcium. L'incertitude sur la mesure du pH est de 0,2, ce qui est habituel pour ce type de mesure. En utilisant la relation entre le pH et la concentration en Nuon Oxonium, on détermine que la concentration en H3O plus est entre 2,5 10,8 et 6,3 10,8 mol par litre. Ensuite, en utilisant la formule de la concentration massique et la masse molaire de H3O plus, on trouve que la concentration massique est entre 4,8 10,7 et 1,2 10,6 g par litre. On compare ensuite la concentration en ion oxonium trouvée avec celle en ion calcium donnée, en passant les concentrations en molaire et en faisant le rapport. On trouve alors qu'il y a environ 300 000 fois plus d'ion calcium que d'ion oxonium dans cette bouteille.
Physique-Chimie
Chimie
Terminale

Détartrage
Bonjour à tous, dans cette vidéo, nous allons aborder le sujet du détartrage. Pendant le détartrage, le carbonate de calcium, principal constituant du tartre, réagit avec l'acide lactique selon la réaction suivante : CaCO3 + 2AH -> CO2 + H2O + Ca2+(aq) + 2A-(aq). Nous allons suivre le protocole suivant : dans un ballon, nous ajoutons 10 ml de la solution de détartrage contenant de l'acide lactique, dilué 10 fois. Nous introduisons ensuite 0,2 g de carbonate de calcium. Nous fermons le ballon avec un bouchon équipé d'un tube relié à un capteur de pression pour mesurer la pression du dioxyde de carbone émis. Après 10 minutes, nous relevons une pression de 155 hectopascals et un volume de dioxyde de carbone de 310 ml. Le graphique suivant montre l'évolution du volume molaire d'un gaz en fonction de la pression à 25 degrés. Maintenant, passons aux questions. Premièrement, pourquoi la réaction étudiée est-elle une réaction acido-basique ? Dans une réaction acido-basique, il y a échange de protons entre l'acide et la base. Dans ce cas, le CO₃²- joue le rôle de la base conjuguée de l'acide CO₂ et l'acide AH a comme base conjuguée A-. Deuxièmement, est-ce que le carbonate de calcium a été complètement consommé au moment du relevé expérimental ? Pour le déterminer, nous devons utiliser le tableau d'avancement. En calculant, nous obtenons une quantité de carbonate de calcium restante de 1,8 x 10-3 mol, ce qui signifie qu'il n'a pas été complètement consommé. Ensuite, quelle est la concentration minimale en acide lactique de la solution de détartrage ? Pour répondre à cette question, nous devons déterminer la quantité d'acide lactique consommée, qui est égale à la quantité de dioxyde de carbone émis. En utilisant les valeurs données, nous trouvons une concentration minimale en acide lactique de 0,38 mol/L. Voilà, c'est la fin de cet exercice. N'ayez pas peur des grandeurs utilisées, il suffit d'appliquer les équations les plus simples et de ne pas perdre le fil de ce que nous faisons. Merci de nous avoir suivi et à bientôt !
Physique-Chimie
Chimie
Terminale

Espèce amphotère
Dans cette vidéo, nous étudions l'acide phosphorique, un triacide couramment utilisé en synthèse organique et comme régulateur de pH dans les systèmes d'irrigation. Les trois couples acides-bases auxquels il appartient sont H3PO4/H2PO4-, H2PO4-/HPO4 2-, et HPO4 2-/PO4 3-. Parmi ces espèces, seules H2PO4- et HPO4- sont amphotères, c'est-à-dire qu'elles peuvent agir à la fois comme acide et comme base dans différents couples. Cela fait d'elles des espèces intéressantes en termes d'acide-base. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
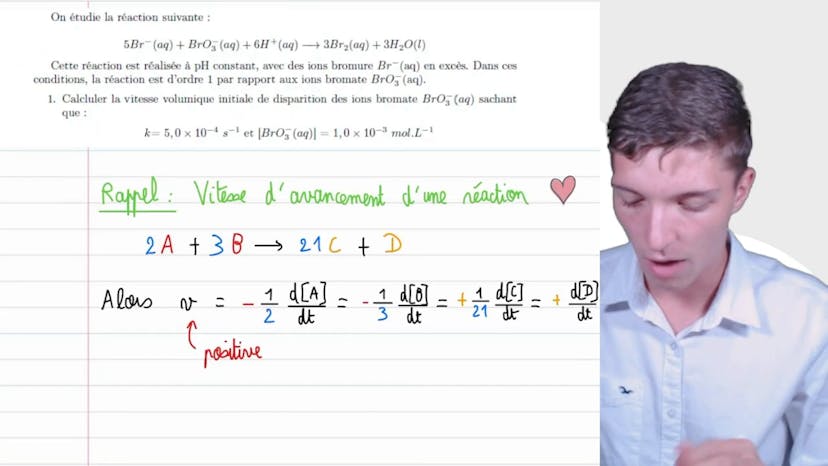
Vitesse volumique
Dans cette vidéo, nous étudions les vitesses volumiques de réaction. La réaction que nous étudions est la suivante : 5Br- + BrO3- + 6H+ donne 3Br2 + 3H2O. Cette réaction est d'ordre 1 par rapport aux ions de bromate, BrO3-. Nous devons calculer la vitesse volumique initiale de disparition des ions de bromate sachant que la constante de réaction, k, est égale à 5x10^-4 secondes^-1 et que la concentration initiale en BrO3- est de 10^-3 mol/L.
La vitesse d'avancement d'une réaction est définie comme la variation de la concentration d'un réactif par rapport au temps. Pour les réactifs, la vitesse est négative, donc on utilise un signe moins pour compenser cela. Pour les produits, la vitesse est positive. La vitesse de disparition des ions bromate est définie comme la vitesse de réaction pour cette réaction spécifique. On doit évaluer cette vitesse en utilisant la cinétique d'ordre 1. Selon la cinétique d'ordre 1, la vitesse de réaction est égale à la constante de réaction, k, multipliée par la concentration à l'ordre 1 des ions bromate.
Ainsi, la vitesse de disparition est égale à k multiplié par la concentration en ions bromate au cours du temps. Pour obtenir la vitesse initiale, on évalue cette proposition à l'instant initial. La vitesse volumique initiale de disparition des ions bromate est donc égale à K multiplié par la concentration initiale en ions bromate. L'application numérique nous donne une vitesse volumique initiale de 5x10^-7 mol/(L·s).
Il est important de comprendre et de manipuler les différentes vitesses d'avancement, de disparition et d'apparition des réactions. En utilisant les définitions appropriées, nous pouvons exprimer ce que nous voulons calculer. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
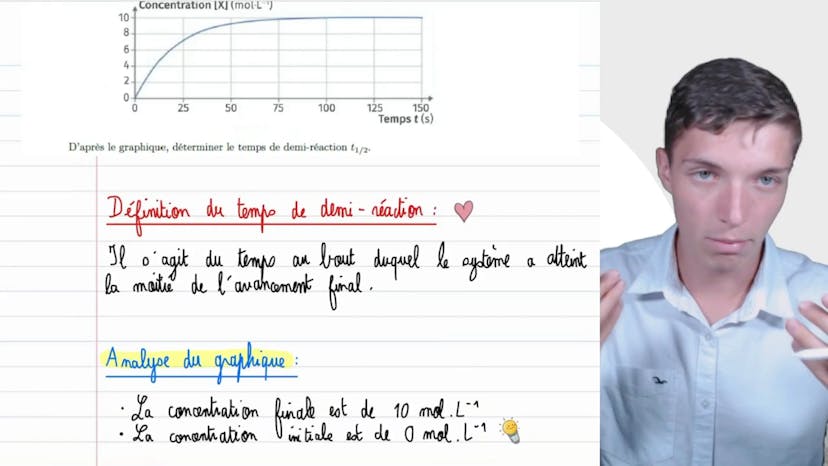
Temps de demi-réaction
Dans cette vidéo, Matisse de Studio explique le concept de temps de demi-réaction. Le graphique présenté montre l'évolution de la concentration d'une espèce au fil du temps lors d'une réaction chimique. L'objectif est de trouver le temps de demi-réaction T1,5 de cette réaction. Le temps de demi-réaction correspond au moment où le système atteint la moitié de l'avancement final.
Pour déterminer le temps de demi-réaction, il faut d'abord connaître la concentration finale, c'est-à-dire la concentration lorsque la réaction s'arrête. Dans ce cas, la concentration finale est de 10 mol par litre.
Ensuite, il faut trouver la moitié de cette concentration finale sur le graphique, soit 5 mol par litre. En analysant le graphique, on peut voir que cette concentration est atteinte après 15 secondes.
Ainsi, le temps de demi-réaction de cette réaction est de 15 secondes.
Cette méthode est importante en chimie, en particulier dans les réactions nucléaires.
Merci d'avoir regardé cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Suivi expérimental
Dans cette vidéo, nous examinons les méthodes pour suivre une réaction cinétique entre le diiode (I2) et le dihydrogène (H2). L'équation de réaction est : H2 + I2 → 2H+ + 2I-.
Pour suivre l'évolution de cette transformation, nous utilisons des capteurs adaptés. Si la réaction implique des espèces colorées, nous utilisons un spectrophotomètre pour mesurer l'absorbance de la couleur jaune due au diiode. L'absorbance diminuera au fur et à mesure que le diiode est consommé.
Si la réaction implique des espèces chargées, nous utilisons un conductimètre pour mesurer la conductivité. La conductivité augmentera car les espèces chargées sont produites pendant la réaction.
Si la réaction implique des ions H+, nous utilisons un pHmètre pour mesurer le pH. Le pH diminuera car des ions H+ sont produits.
Il est important de retenir ces méthodes et de savoir les utiliser dans les exercices. En analysant les différentes espèces présentes dans une réaction, nous pouvons choisir la méthode de suivi adaptée. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
Etude de graphe
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
Terminale

Rôles annexes
Dans cette vidéo, nous étudions l'influence de certains paramètres de réaction sur la cinétique de celle-ci. Nous avons deux expériences, A et B, avec des mélanges initiaux identiques. L'expérience A est réalisée à 20 degrés tandis que l'expérience B est réalisée à 35 degrés. Nous mesurons la quantité de produits formés pendant des durées égales ΔTj.
La première question porte sur le rôle de la concentration des réactifs sur la rapidité d'évolution du système. Il est important de noter que nous ne pouvons pas simplement comparer les expériences A et B car les mélanges initiaux sont identiques. La différence se situe donc dans les différents états du système au fil du temps. Pour un même intervalle de temps, nous formons plus de produits lors de ΔT1 que lors de ΔT2 et ΔT3. Ainsi, nous pouvons conclure que plus la concentration en réactif est élevée, plus la vitesse de réaction est importante.
Ensuite, nous examinons le rôle de la température sur la cinétique de la réaction. Nous comparons l'expérience A à 20 degrés avec l'expérience B à 35 degrés. La quantité de produits formés pour chaque intervalle de temps est plus importante à 35 degrés. Nous pouvons donc conclure que plus la température est élevée, plus la vitesse de réaction est importante, conformément à la loi de Van't Hoff.
En résumé, nous avons étudié l'influence de la concentration des réactifs et de la température sur la cinétique d'une réaction chimique. Ces questions sont essentielles en synthèse industrielle et dans le domaine de la recherche. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
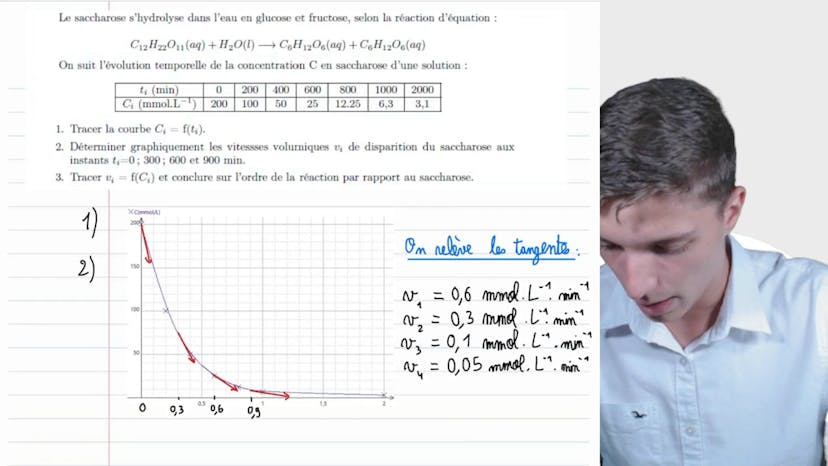
Hydrolyse du saccharose
Dans cette vidéo, nous étudions l'hydrolyse du saccharose. Le saccharose se décompose en glucose et en fructose dans l'eau. La réaction est la suivante : C12H22O11 + H2O donne C6H12O6 + C6H12O6. Le glucose et le fructose sont des isomères, ce qui signifie qu'ils ont la même formule brute.
Nous observons l'évolution temporelle de la concentration en saccharose dans une solution. La concentration est exprimée en millimoles par litre et le temps en minutes. Il est important de bien repérer les unités pour éviter les erreurs dans les résultats.
La première question consiste à tracer la courbe de concentration en fonction du temps. Pour cela, nous utilisons un tableau et le logiciel de régression si disponible. Ensuite, nous déterminons graphiquement les vitesses volumiques de disparition du saccharose aux instants 0, 300, 600 et 900 minutes. La vitesse volumique de disparition correspond à la pente de la tangente à la courbe de concentration en fonction du temps. Elle est positive car il s'agit d'une vitesse de disparition.
Les vitesses volumiques de disparition obtenues sont les suivantes : V1 = 0,6 mmol/L/min, V2 = 0,3 mmol/L/min, V3 = 0,1 mmol/L/min, et V4 = 0,05 mmol/L/min.
Ensuite, nous traçons les différentes vitesses en fonction de la concentration. Mis à part la dernière mesure qui fausse légèrement les résultats, nous obtenons une droite caractéristique d'une cinétique d'ordre 1. Cela signifie que la vitesse est proportionnelle à la concentration, conformément à l'équation V = k * c. Cette conclusion est également cohérente avec le temps de demi-vie de la réaction, qui est indépendant de la concentration initiale en réactif. Dans une réaction d'ordre 1, le temps de demi-réaction est égal à ln(2)/k et ne dépend pas de la concentration initiale.
En conclusion, l'ordre de la réaction par rapport au saccharose est de 1. Il est recommandé de revoir la méthode si vous n'avez pas encore assimilé cette configuration classique de détermination de l'ordre de réaction.
Merci d'avoir suivi cette vidéo. À bientôt !
Physique-Chimie
Chimie
Terminale

Détermination d'ordres
Bonjour à tous ! Dans cette vidéo, nous allons déterminer les ordres partiels de réaction. Nous étudierons la réaction entre les ions iodure (I-) et les ions fer 3 (Fe3+), représentée par l'équation 2I- + 2Fe3+ -> I2 + 2Fe2+. La vitesse initiale de disparition des ions iodure (VdispI-0) peut être exprimée comme VdispI-0 = K * [I-]initial^alpha * [Fe3+]initial^beta. Nous devons trouver les valeurs des ordres partiels alpha et beta.
Nous réalisons deux séries de mesures expérimentales pour déterminer les vitesses initiales de disparition des ions iodure. Dans chaque série, nous fixons la concentration initiale d'une espèce : dans la première série, la concentration d'I- est toujours de 4 mol/l, et dans la deuxième série, la concentration de Fe3+ est de 1,7 mol/l.
Dans la première série de mesures, la concentration initiale de I-^0 à la puissance alpha est une constante, que nous pouvons regrouper avec la constante de vitesse K. Ainsi, la vitesse de disparition dépend uniquement de la concentration de Fe3+. Nous pouvons donc tracer VdispI- en fonction de [Fe3+], ce qui nous donne une cinétique d'ordre 1.
Dans la deuxième série de mesures, nous traçons Vdisp en fonction de I-^0I à la puissance alpha. Cette relation ressemble à une parabole, typique d'une cinétique d'ordre 2. En considérant que la concentration de Fe3+ est fixée, nous concluons que alpha est égal à 2.
Ainsi, nous obtenons la loi de vitesse suivante : la vitesse de disparition des ions I- initial est égale à k * [I-]initial^2 * [Fe3+]initial^1.
Cet exercice est essentiel et nous permet de réviser l'analyse classique de la cinétique chimique. Il montre également comment réduire l'ordre global d'une réaction en fixant la concentration d'un réactif. Cette méthode est importante à retenir. Merci de votre attention et à bientôt !
Physique-Chimie
Chimie
Terminale
Vocabulaire
Aucun résumé n'est disponible pour cette vidéo
Physique-Chimie
Chimie
Terminale

Le lait tourne
Dans cette vidéo sur la chimie cinétique pratique, nous étudions la dégradation du lactose en acide lactique dans le lait sous l'action de bactéries. Cette dégradation, ou "tournage" du lait, se manifeste par un changement de couleur et d'odeur. À une température de 28°C, le lait tourne en 4 heures. Nous voulons savoir combien de temps il faudra pour que le lait tourne au réfrigérateur, où la température est de 5°C. Pour cela, nous disposons des données suivantes : l'énergie d'activation de la réaction est de 75,1 kJ/mol, la concentration de lactose dans le lait suit une loi exponentielle, et la température doit être convertie de degrés Celsius à Kelvin.
Nous devons définir la concentration de lactose à partir de laquelle nous considérons que le lait a tourné, notée CL. Selon la loi exponentielle, CL = C0 * exp(-KT), où K est une constante proportionnelle à exp(-Ea/RT), C0 est la concentration initiale de lactose et T est la température du système en Kelvin. Nous pouvons exprimer CL dans le cas de la température chaude (28°C) et dans le cas de la température froide (5°C).
En isolant Tlf, le temps limite à partir duquel le lait a tourné à la température froide, nous obtenons l'équation Tlf = Tlc * exp(Ea/RT) * (1/Tf - 1/Tc).
En effectuant les calculs appropriés à partir des données fournies, nous trouvons que Tlf est égal à 54 heures, ce qui est beaucoup plus long que les 4 heures à température ambiante. Ainsi, la conclusion de l'exercice est qu'il est préférable de conserver le lait au réfrigérateur pour prolonger sa durée de conservation.
En résumé, cet exercice de chimie cinétique pratique aborde la dégradation du lactose dans le lait et démontre l'importance de le conserver au réfrigérateur.


