 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
MPSI/PCSI

Energie d'activation
Dans cette vidéo, Matisse de Studio explique comment calculer l'énergie d'activation d'une réaction chimique en utilisant la formule d'Arenus. Il commence par expliquer que la vitesse de réaction double lorsque la température passe de 300 Kelvin à 400 Kelvin. Il fait l'hypothèse que la constante de vitesse double également. En utilisant la loi d'Arenus, il montre que la constante de vitesse est égale à A multiplié par l'exponentielle de moins EA/RT, où EA représente l'énergie d'activation, A est un facteur pré-exponentiel, R est la constante des gaz parfaits et T est la température de réaction. Sachant que la constante de vitesse double, il nomme K1 et K2 les constantes de vitesse pour les réactions réalisées à 300 Kelvin et 400 Kelvin respectivement. En utilisant la loi d'Arenus, il établit l'équation K2 = 2K1. En simplifiant l'équation, il isole l'énergie d'activation EA et trouve que EA est égal à R ln 2 divisé par 1/T1 - 1/T2. Il conclut que l'énergie d'activation de la réaction est de 6,9 kJ/mol. Il conseille de prendre son temps pour comprendre l'énoncé, donner des noms aux variables et utiliser la formule d'Arenus pour résoudre l'exercice.
Physique-Chimie
Chimie
MPSI/PCSI
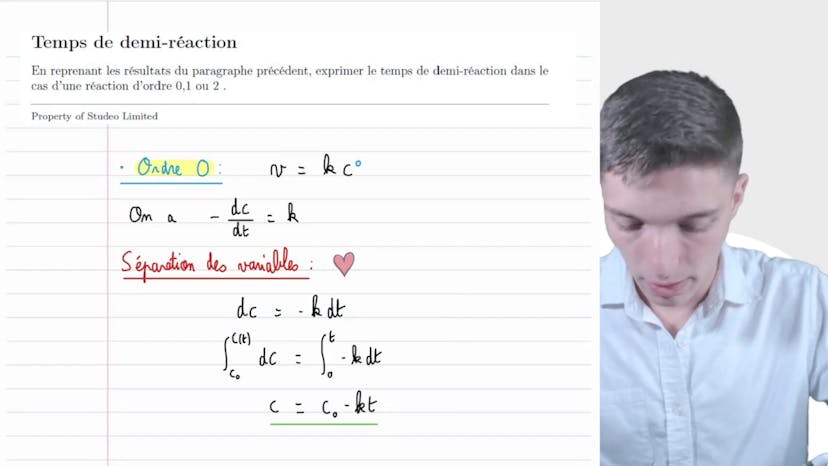
Temps de demi réaction
Dans cette vidéo, Mathis de Studio traite des différents temps de demi-réaction pour les réactions d'ordre 0, 1 et 2. Il explique que ces notions sont essentielles à connaître pour les examens et les exercices.
Pour les réactions d'ordre 0, la vitesse de réaction peut être exprimée comme V = k * [A]^0, où [A]^0 représente la concentration d'une espèce qui disparaît. En résolvant cette équation, on obtient que la concentration en fonction du temps est donnée par c = c0 - kt, où c0 est la concentration initiale et k est la constante de vitesse. Le temps de demi-réaction peut alors être calculé en résolvant c = c0/2, ce qui donne t1/2 = c0/(2k).
Pour les réactions d'ordre 1, la vitesse de réaction peut être exprimée comme V = k * [A]^1, où [A]^1 représente la concentration d'une espèce qui disparaît avec un coefficient stoichiométrique de 1. En suivant les étapes similaires, on obtient que la concentration en fonction du temps est donnée par c = c0 * e^(-kt). Le temps de demi-réaction peut alors être calculé en résolvant c = c0/2, ce qui donne t1/2 = ln(2)/k.
Enfin, pour les réactions d'ordre 2, la vitesse de réaction peut être exprimée comme V = k * [A]^2, où [A]^2 représente la concentration d'une espèce qui disparaît avec un coefficient stoichiométrique de 2. En suivant les étapes similaires, on obtient que la concentration en fonction du temps est donnée par c = c0/(1 + c0kt). Le temps de demi-réaction peut alors être calculé en résolvant c = c0/2, ce qui donne t1/2 = 1/(c0k).
En résumé, cette vidéo explique comment déterminer les temps de demi-réaction pour les réactions d'ordre 0, 1 et 2, en utilisant les équations d'évolution de la concentration en fonction du temps.
Physique-Chimie
Chimie
MPSI/PCSI
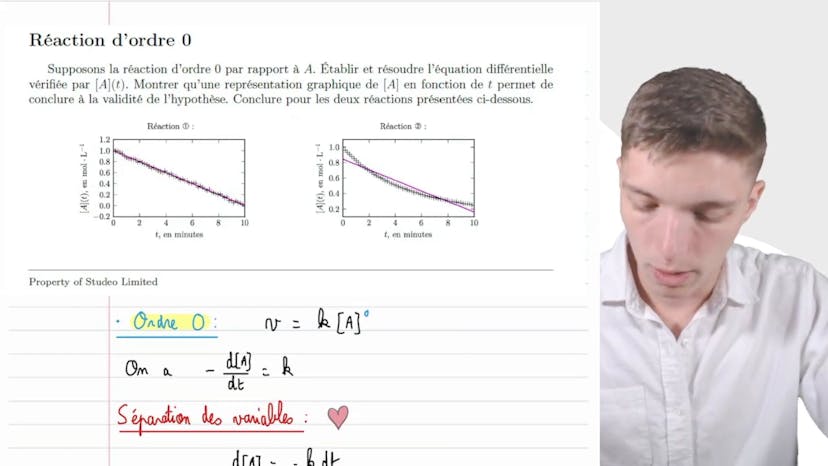
Réaction d'odre 0
Dans cette vidéo, nous vérifions si une réaction chimique est d'ordre zéro ou non. Pour cela, nous faisons une hypothèse sur l'ordre de réaction et examinons les conséquences de cette hypothèse sur la cinétique de la réaction. Nous devons établir et résoudre l'équation différentielle qui décrit la concentration du réactif en fonction du temps. En analysant la représentation graphique de la concentration en fonction du temps, nous pouvons conclure si notre hypothèse est valide ou non. Dans cet exercice, nous obtenons deux courbes différentes pour les deux réactions étudiées. La première courbe est une droite qui passe par tous les points, indiquant une cinétique d'ordre zéro, tandis que la deuxième courbe est une courbe polynomial ou convexe, indiquant une cinétique différente de l'ordre zéro. En résolvant l'équation différentielle, nous obtenons une fonction affine décroissante pour la première réaction, confirmant notre hypothèse. En conclusion, la première réaction est d'ordre zéro par rapport au réactif A, tandis que la deuxième réaction n'est pas d'ordre zéro. Cette analyse nous permet de déterminer l'ordre de réaction à partir de la courbe d'évolution de la concentration. C'est un exemple puissant de la puissance des calculs analytiques et des observations expérimentales en cinétique chimique.
Physique-Chimie
Chimie
MPSI/PCSI

Vitesse de réaction
Dans cette vidéo, Mathis explique le lien entre la vitesse de réaction et la concentration. Il commence par donner une équation bilan pour une réaction chimique donnée. Il construit ensuite un tableau d'avancement de la réaction en termes de concentration. Il déduit ensuite l'expression de l'avancement volumique en fonction de la concentration pour chaque espèce. Ensuite, il montre que la vitesse de réaction est simplement la dérivée de l'avancement volumique par rapport au temps. Il démontre ainsi l'expression de la vitesse de réaction en fonction de la concentration des ions. Il conclut en soulignant l'importance de comprendre ces concepts en chimie.
Physique-Chimie
Chimie
MPSI/PCSI
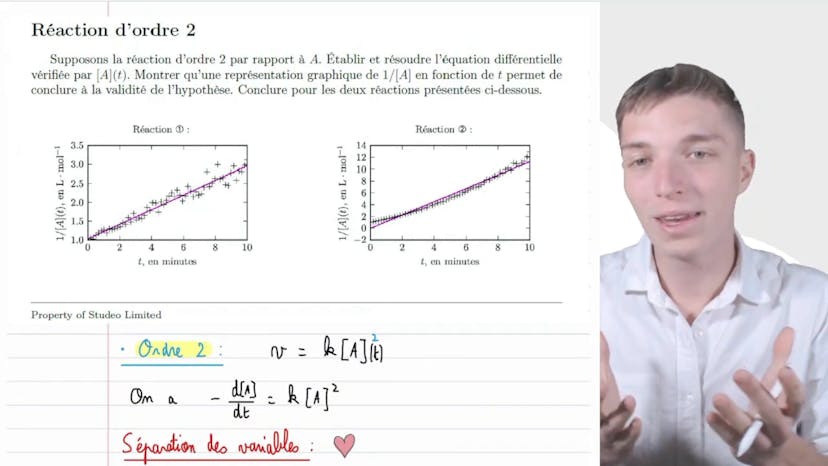
Réaction d'ordre 2
Dans cette vidéo, nous allons vérifier si une réaction est d'ordre 2 ou non. Pour cela, nous supposons que la réaction est d'ordre 2 par rapport au réactif A. Nous devons établir et résoudre l'équation différentielle vérifiée par la concentration de A en fonction du temps. Une représentation graphique de 1/concentration en fonction du temps nous permettra de conclure à la vérité de l'hypothèse pour les deux réactions présentées.
Pour la réaction 1, nous observons une droite qui peut être modélisée et qui passe par la plupart des points. Cela est cohérent. Pour l'autre réaction, nous avons un polynôme qui est mal approximé par la régression linéaire.
Pour exprimer 1/concentration en fonction du temps, nous utilisons l'équation v=k[A]^2. En effectuant la séparation des variables et en intégrant, nous obtenons la relation 1/concentration à l'instant t = kt + 1/concentration initiale.
Cette relation nous dit que la courbe de 1/concentration en fonction du temps est une fonction affine et croissante. Ainsi, la réaction 1 présente une cinétique d'ordre 2 par rapport à A. Ce n'est pas le cas pour la réaction 2.
En conclusion, en analysant l'évolution de la concentration en fonction du temps, nous pouvons déterminer l'ordre de la réaction. Cette démarche est puissante et nous permet de comprendre les caractéristiques cinétiques des réactions. Merci d'avoir visionné cette vidéo et à bientôt !
Physique-Chimie
Chimie
MPSI/PCSI

Décomposition de l'éthanal
Dans cette vidéo, nous étudions la décomposition de l'éthanal (CH3CHO) en méthane (CH4) et monoxyde de carbone (CO). Les composés sont tous gazeux. Nous sommes également dans une enceinte fermée et indéformable, avec une pression initiale P0.
Nous écrivons l'équation de la réaction et construisons le tableau d'avancement. On constate que la mesure de la pression à l'intérieur de l'enceinte permet de suivre l'avancement de la réaction, car elle dépend directement du nombre de moles des différents composés. On exprime la pression en fonction de l'avancement et des molécules présentes.
Ensuite, on montre expérimentalement que la fonction f est proportionnelle à la température T. On utilise la formule de la concentration en éthanal pour une réaction d'ordre 2 et exprimons f en fonction de cette formule. On démontre alors que f est une fonction linéaire du temps, ce qui est compatible avec une réaction d'ordre 2.
Nous calculons ensuite le temps de demi-réaction en utilisant les informations disponibles et obtenons l'expression V/(N0*K), typique d'une réaction d'ordre 2. Enfin, nous notons que si le volume est doublé, le temps de demi-réaction sera également deux fois plus important.
En conclusion, cet exercice nous montre l'importance d'exprimer les grandeurs en fonction des hypothèses et des formules disponibles. Il permet également de comprendre comment mesurer et suivre l'avancement d'une réaction grâce à une grandeur physique, comme la pression.
Physique-Chimie
Chimie
MPSI/PCSI

Ions iodures et ferriques
Dans cette vidéo, Matisse de Studio explique le processus d'oxydation des ions iodure par les ions fériques. Il présente une équation de bilan : 2Fe3+ + 2I- -> 2Fe2+ + I2.
Il réalise deux séries d'expériences à température constante pour déterminer les vitesses initiales en utilisant une méthode appelée "horloge à iode". Pour la première série, la concentration initiale en I- est fixée à 4x10^-3 mol/L, tandis que pour la deuxième série, c'est la concentration initiale en Fe3+ qui est fixée à 1,67x10^-3 mol/L.
Ensuite, il propose un modèle mathématique pour exprimer la vitesse initiale de réaction en fonction des concentrations initiales des réactifs. En utilisant une régression linéaire, il détermine les ordres partiels de réaction par rapport à I- (α) et par rapport à Fe3+ (β). Il obtient β = 1 et α = 2.
Il utilise également les résultats de la régression linéaire pour déterminer les constantes de vitesse apparentes (K-up et K'). Enfin, il calcule la valeur de la constante de vitesse (K) à partir de K' et de la concentration initiale en Fe3+.
En conclusion, Matisse établit la loi de vitesse initiale de la réaction étudiée : V0 = K [I-]^2 [Fe3+]^1, avec K = 4,55 mol-2 L2s-1. Il souligne que ces résultats concernent uniquement la vitesse initiale de réaction.
Physique-Chimie
Chimie
MPSI/PCSI

Loi d'Arrhenius
Dans cette vidéo, Mathis de Studio explique la loi d'Arenius qui concerne la décomposition du pâte à oxyde d'azote N2O5 en dioxyde azote NO2 et en dioxygène à une température de θ supérieure ou égale à 150°C. Il démontre comment écrire l'équation de la réaction en utilisant les nombres stoichiométriques appropriés.
Il poursuit en expliquant comment déterminer l'ordre alpha de la réaction et la constante cinétique K grâce à une étude cinétique menée à différentes températures. Il souligne qu'en repérant l'unité de la constante de vitesse K (exprimée en secondes moins 1), on peut déduire que l'ordre alpha de la réaction est 1. Il propose ensuite une loi de vitesse qui relie la vitesse de la réaction à la concentration de N2O5.
Ensuite, Mathis examine les données expérimentales fournies pour déterminer si elles sont compatibles avec la loi d'Arenius. Il explique comment effectuer une régression linéaire en utilisant la loi d'Arenius pour relier ln de K à 1 sur T. Les constantes obtenues dans la régression linéaire permettent de déterminer l'énergie d'activation et le facteur préexponentiel de la réaction. Les résultats obtenus sont une énergie d'activation de 15,0 kJ par mol et un facteur préexponentiel de 29,7 X 10³.
En résumé, cette vidéo explique la loi d'Arenius concernant la décomposition du N2O5, détermine l'ordre alpha et la constante cinétique K, et effectue une régression linéaire pour obtenir des valeurs pour l'énergie d'activation et le facteur préexponentiel.
Physique-Chimie
Chimie
MPSI/PCSI

Souffre radioactif
Dans cette vidéo, on étudie l'utilisation possible du soufre radioactif en tant que traceur biologique. L'isotope radioactif du soufre 38 est utilisé pour étudier le métabolisme des protéines. On commence avec un échantillon de protéines marqué avec cet isotope, qui a une activité initiale de 4,8 x 10^4 désintégrations par minute. On souhaite calculer l'activité de cet échantillon après 8 heures et 24 heures.
Pour résoudre ce problème, on utilise la décroissance exponentielle de l'isotope radioactif. On pose une expression pour la concentration en isotope en fonction du temps, en utilisant la concentration initiale et la constante de décroissance. On utilise également la définition de la demi-vie, qui indique que la concentration à n'importe quel instant est égale à la concentration initiale divisée par deux après une durée de demi-vie.
En résolvant l'équation obtenue, on détermine la constante de décroissance alpha, qui permet ensuite d'exprimer la loi de concentration de l'isotope. On peut alors calculer la vitesse de décroissance en utilisant la dérivée temporelle de la concentration.
Cependant, on dispose de l'activité initiale de l'échantillon, qui est la vitesse de disparition de l'isotope, plutôt que de sa concentration initiale. On calcule donc la vitesse initiale en utilisant cette activité. On peut ensuite utiliser toutes ces informations pour calculer l'activité de l'échantillon après 8 heures et 24 heures.
En effectuant les calculs numériques, on obtient une activité de 6812 désintégrations par minute après 8 heures et 137 désintégrations par minute après 24 heures.
Malgré la complexité de cet exercice, il est important de prendre des initiatives et d'essayer différentes approches pour résoudre le problème. Même si on se trompe, cela permet de progresser et de trouver la bonne solution. Il faut donc se lancer, être confiant et ne pas avoir peur de se tromper.
Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
MPSI/PCSI

Mise en solution d'un acide
Dans cette vidéo, on aborde l'équilibre chimique, qui est une notion importante en chimie. On commence par un exercice où on met un acide en solution. L'acide éthanoïque réagit de façon acido-basique avec l'eau selon l'équation CH3COH + H2O donne CH3CO- + H3O+. On travaille avec une solution d'acide éthanoïque de concentration C0 égale à 1 fois 10 puissance moins 3 mol par litre. On nous demande quelle grandeur on peut mesurer pour déterminer l'avancement volumique final XF. Pour répondre à cette question, on peut utiliser un tableau d'avancement en calculant les concentrations initiale et finale des espèces. On remarque que la concentration finale de H3O+ (XF) est égale à la concentration initiale de H3O+ à l'équilibre. Donc, on peut mesurer le pH pour déterminer l'avancement de la réaction. Ensuite, on nous demande de déterminer le pH lorsque la transformation est totale, c'est-à-dire XF=C0. Dans ce cas, la concentration de H3O+ à l'équilibre est égale à C0. En utilisant la formule du pH, on obtient pH=-log(C0). L'application numérique donne un pH final de 3. En conclusion, cet exercice nous permet de comprendre l'état final d'une réaction et son lien avec le pH, et nous allons étudier plus en détail ce sujet dans les exercices suivants.
Physique-Chimie
Chimie
MPSI/PCSI

Quotient réactionnel
Bonjour à tous ! Dans cette vidéo, nous allons aborder le quotient réactionnel en thermodynamique chimique. Le quotient réactionnel, noté Q, est défini comme le produit des activités des produits divisé par le produit des activités des réactifs. Les activités dépendent de l'état de l'espèce considérée. Pour une espèce gazeuse, l'activité est donnée par la pression partielle divisée par une constante P0. Pour une espèce en solution, l'activité est donnée par la concentration divisée par une constante C0. Pour le solvant ou un solide, l'activité est conventionnellement fixée à 1. Le quotient réactionnel est utilisé pour exprimer l'avancement d'une réaction chimique. Pour une réaction donnée, le quotient réactionnel est le produit des activités des produits divisé par le produit des activités des réactifs. Nous illustrons cette définition avec trois exemples de réactions. Dans chaque cas, nous identifions les valeurs des coefficients stoichiométriques et des activités. Nous simplifions ensuite l'expression du quotient réactionnel en regroupant les termes communs et en annulant les constantes C0. Finalement, nous vérifions que le quotient réactionnel est homogène et cohérent avec l'expression théorique. Il est important de bien comprendre le quotient réactionnel pour analyser l'évolution du système chimique. N'hésitez pas à pratiquer des exercices supplémentaires pour vous entraîner. Merci de nous avoir suivi et à bientôt !
Physique-Chimie
Chimie
MPSI/PCSI

Activités chimiques
Dans cette vidéo, Mathis explique en détail le concept d'activité chimique et comment l'utiliser pour calculer des quotients de réaction et des constantes d'équilibre. Il explique que l'activité d'une espèce gazeuse est égale à sa pression partielle divisée par la pression standard, tandis que l'activité d'une espèce en solution aqueuse est égale à sa concentration divisée par la concentration standard. Il souligne également que l'activité d'un solvant ou d'un solide est toujours égale à 1.
Ensuite, il donne des exemples concrets pour illustrer ces concepts. Il explique que la limaille de fer versée dans un verre d'eau pure est un solide, donc son activité est égale à 1. Il montre également que la solution d'acide chlorhydrique a une concentration de 1x10^-2 mol/L, ce qui correspond à son activité. Pour une bouteille d'hélium à 200 bar, il explique que l'hélium est un gaz, donc son activité est égale à la pression partielle en helium divisée par la pression standard, ce qui donne un résultat de 200. Enfin, il explique comment calculer les activités de diazote et de dioxygène dans l'air en utilisant les fractions molaires de ces gaz, qui sont respectivement d'environ 80% et 20%. En utilisant la pression totale de l'air (1 bar) comme pression standard, il obtient des activités de 0,8 pour le diazote et 0,2 pour le dioxygène.
Il conclut en disant que maintenant que nous avons une meilleure compréhension de la notion d'activité chimique, nous pourrons l'utiliser dans les exercices à venir.


