 All subjects
All subjects
 All subjects
All subjects
Physique-Chimie
Chimie
Terminale
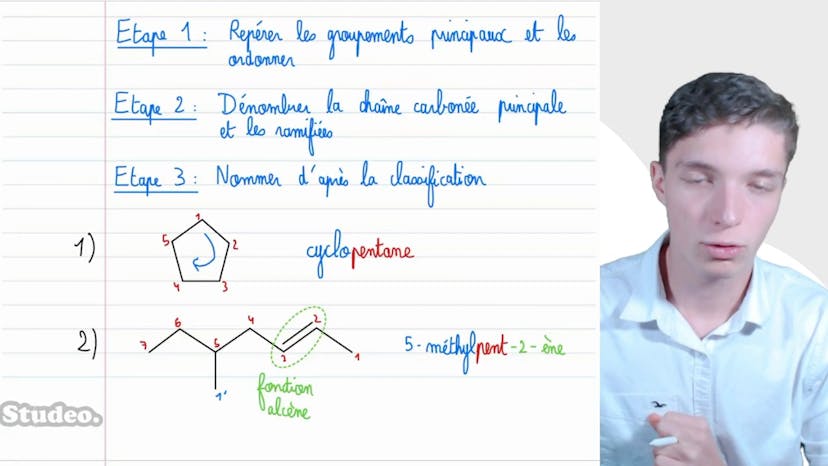
Nomenclature
Dans cette vidéo, Matisse de Studio aborde l'organisation en chimie organique, en commençant par la nomenclature. Il explique qu'il faut représenter la formule topologique et nommer chaque molécule dans la formule semi-développée. Il souligne l'importance de connaître la nomenclature par cœur. La première étape est de repérer les groupements principaux et de les ordonner selon des règles de priorité. Ensuite, il faut dénombrer la chaîne carbonée principale et les chaînes ramifiées. Après cela, il est nécessaire de nommer d'après la classification. Matisse donne des exemples de molécules et explique comment les nommer en suivant ces étapes. Il mentionne également la concept de stéréoisomérie et note qu'apprendre les appellations des alkanes est également important. Malgré la complexité de la nomenclature, Matisse encourage à ne pas se décourager et à voir cela comme un défi amusant. Il conclut en soulignant l'utilité de la formule topologique pour nommer et manipuler les molécules en chimie organique.
Physique-Chimie
Chimie
Terminale
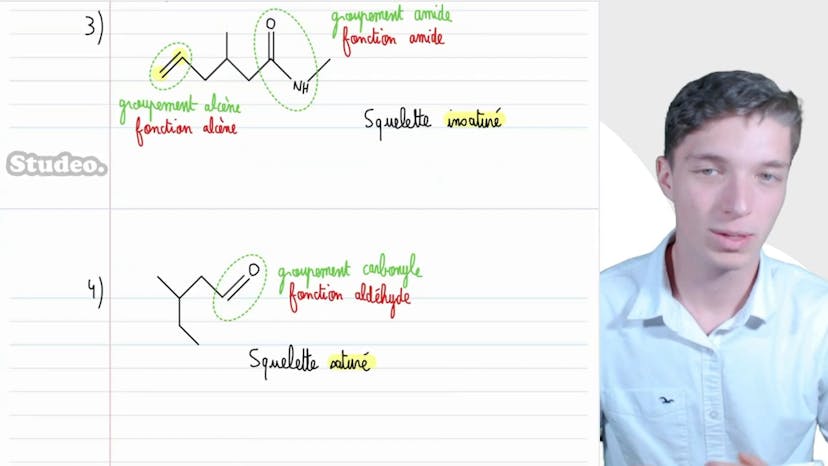
Squelette et groupe
Dans cette vidéo, Matisse de Studio explique les différentes caractéristiques d'un squelette carboné. Il aborde la notion de repérer les groupes caractéristiques et les associer à une famille fonctionnelle dans les molécules présentées. Il souligne également l'importance de déterminer si le squelette carboné est saturé ou non. Pour la première molécule, il identifie un groupement amine associé à la fonction amine et un squelette saturé. Pour la deuxième molécule, il identifie un groupement alcène associé à la fonction alcène, un groupement estère associé à la fonction estère, et un squelette insaturé. Pour la troisième molécule, il identifie un groupement amide associé à la fonction amide et un squelette insaturé. Pour la quatrième molécule, il identifie un groupement carbonyl associé à la fonction aldéhyde et un squelette saturé. Pour la cinquième molécule, il identifie un groupement carbonyl associé à la fonction cétone et un groupement carboxyle associé à la fonction acide carboxylique, ainsi qu'un squelette saturé. Il conclut en soulignant l'importance de repérer les groupes caractéristiques et de déterminer si le squelette carboné est saturé ou non pour les exercices de nomenclature et les réactions de chimie organique.
Physique-Chimie
Chimie
Terminale

Isomérie de constitution
Dans cette vidéo, Matisse de Studio aborde l'isomérie de constitution. Il explique que pour chaque couple de formules topologiques présentées, il faut déterminer s'il s'agit d'isomères de constitution ou non. Les isomères de constitution sont des molécules qui ont les mêmes formules brutes, mais des formules semi-développées différentes. Matisse mentionne qu'il existe différents types d'isomérie et que cela peut être facile à comprendre en se référant à un diagramme. Il explique que pour le premier couple de formules, ils n'ont pas la même formule brute, donc ils ne sont pas des isomères de constitution. Pour le deuxième couple de formules, il s'agit en réalité de la même molécule représentée différemment, donc ce ne sont pas des isomères de constitution. Enfin, pour le troisième couple de formules, ils ont la même formule brute mais des formules semi-développées différentes, ce qui fait d'eux des isomères de constitution. Matisse conclut en encourageant les spectateurs à revoir les différents types d'isomérie et à s'exercer à les reconnaître.
Physique-Chimie
Chimie
Terminale
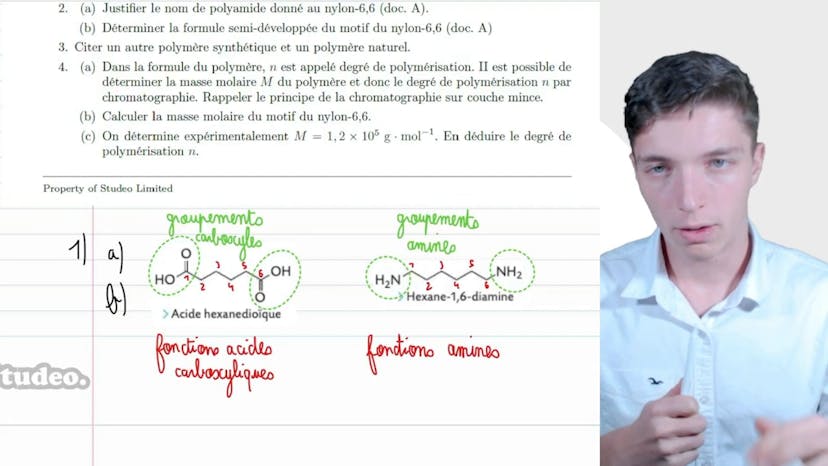
Le nylon
Dans cette vidéo, Mathis du studio nous parle du nylon. Le document A présente le nylon 6-6, un polyamide obtenu par polymérisation utilisé comme soie synthétique. Ce nylon est obtenu par réaction entre l'hexane 1,6 diamine et l'acide hexane diolique.
Le document B parle du recyclage du nylon, avec un procédé d'amonolise qui permet de recycler le nylon. Le procédé comprend la dépolymérisation du nylon avec un excès d'ammoniaque, à des pressions et températures spécifiques, en présence d'un catalyseur au phosphate. Les produits obtenus sont un mélange de monomères et d'eau.
Dans la suite de l'exercice, il faut nommer les réactifs et comprendre le nom du nylon 6-6. Le premier réactif contient des groupements carboxyles (CO) et hydroxyl (OH) tandis que le second réactif contient des groupements amines (NH2). Le nylon 6-6 est appelé ainsi car il est formé de fonctions amides, d'où le terme polyamide.
Ensuite, il est demandé de justifier le type de réaction synthèse du nylon 6-6, qui est une réaction de substitution où l'azote du groupement amine vient substituer le groupement OH.
Il est aussi demandé de comprendre le principe de chromatographie sur couche mince, qui est une technique d'analyse basée sur les différences d'affinités chimiques entre une phase fixe (la plaque) et une phase mobile (l'éluant). Cette technique permet de séparer les différentes substances présentes dans un mélange.
Enfin, il est demandé de calculer la masse molaire du motif du nylon 6-6 et de déduire le degré de polymérisation, qui est le nombre de fois que le motif se répète pour former le polymère tout entier. Le degré de polymérisation du nylon 6-6 est de 531.
Cet exercice aborde plusieurs notions comme la nomenclature, la polymérisation et la chromatographie, qui sont importantes en chimie.
Physique-Chimie
Chimie
Terminale

Le PET
Dans cette vidéo, nous allons nous intéresser à la molécule PET (polyéthylène terephthalate). L'entreprise française Carbios a développé une enzyme capable de décomposer le PET afin de le rendre recyclable. Le PET est largement utilisé dans notre quotidien, notamment pour les bouteilles, les cartes de crédit et les filets de textile. Pour identifier les groupes caractéristiques de cette molécule, nous observons un fragment de PET et utilisons une représentation topologique. Les boules noires représentent les carbones, les boules blanches représentent les hydrogènes et les boules rouges représentent les oxygènes. En identifiant les motifs à partir d'un cycle à 6 carbones, nous pouvons déduire la structure du polymère PET. Quant à la représentation topologique, nous déduisons le nombre de liaisons en fonction des groupements présents. Par exemple, dans le cycle, chaque carbone forme 3 liaisons avec les carbones adjacents, ce qui indique la présence de 3 doubles liaisons. En progressant ainsi, nous pouvons représenter les groupements alcènes et estères présents dans le PET. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Le Rilsan
Le Rilsan, également connu sous le nom de polyamide 11, est un polymère thermoplastique utilisé dans diverses applications telles que les fibres textiles synthétiques, les conduites flexibles et les filets de pêche. Il est obtenu par polycondensation catalysée par des ions hydrogène H+ et de l'acide 11-amino-oundécanoïque issu de l'huile de Rilsan. Le Rilsan est l'un des premiers bioplastiques agrosourcés non biodégradables. Pendant la synthèse, l'eau est continuellement éliminée à haute température (entre 200°C et 220°C). La matière première étant l'huile de Rilsan, le Rilsan est considéré comme un bioplastique agrosourcé. La forme topologique du monomère du Rilsan est une longue chaîne carbonée avec un groupement amine à une extrémité et un groupement carboxyle à l'autre. La polymérisation du Rilsan se fait par polycondensation, où le monomère réagit avec lui-même en formant des liaisons amide. La polymérisation est optimisée cinétiquement grâce à la catalyse acide et à de hautes températures. L'eau est éliminée lors de la synthèse car elle est produite en remplaçant le NH2 dans la doublure de la chaîne carbonée. En éliminant l'eau, on diminue sa concentration dans la réaction, ce qui favorise le déplacement de l'équilibre vers la formation du produit final. Ce processus permet d'obtenir un meilleur rendement de réaction. La vidéo donne une explication détaillée de chaque étape de la polymérisation du Rilsan.
Physique-Chimie
Chimie
Terminale

Insaturation
Dans cette vidéo, Mathis du studio aborde la notion d'insaturation qui est un concept chimique. Il explique que le nombre d'insaturation peut être calculé à partir de la formule brute d'une molécule selon la formule suivante : deux fois le nombre de carbone, plus deux, moins le nombre d'hydrogène, plus le nombre d'azote, moins le nombre d'halogène, le tout divisé par deux.
Mathis utilise l'exemple de l'alizarin, un colorant rouge dont la formule brute est C14H8O4. Il calcule le nombre d'insaturation en appliquant la formule : 2 * 14 + 2 - 8 / 2, ce qui donne 11 insaturation. Il explique que les insaturations correspondent aux liaisons doubles ou aux cycles dans la molécule. Il vérifie ensuite la cohérence en comptant les liaisons doubles et les cycles dans la structure moléculaire de l'alizarin, et obtient bien 8 doubles liaisons et 3 cycles, correspondant au nombre d'insaturation calculé précédemment.
Mathis représente ensuite la formule topologique de l'alizarin en indiquant les doubles liaisons, et identifie les groupes caractéristiques de la molécule. Il mentionne la présence de 6 groupes halcènes et de 2 groupes carbonyles associés à la fonction cétone.
En conclusion, Mathis souligne que le nombre d'insaturation est un concept intéressant qui permet de prédire la structure d'une molécule. Il remercie les spectateurs et conclut la vidéo en leur donnant rendez-vous prochainement.
Physique-Chimie
Chimie
Terminale
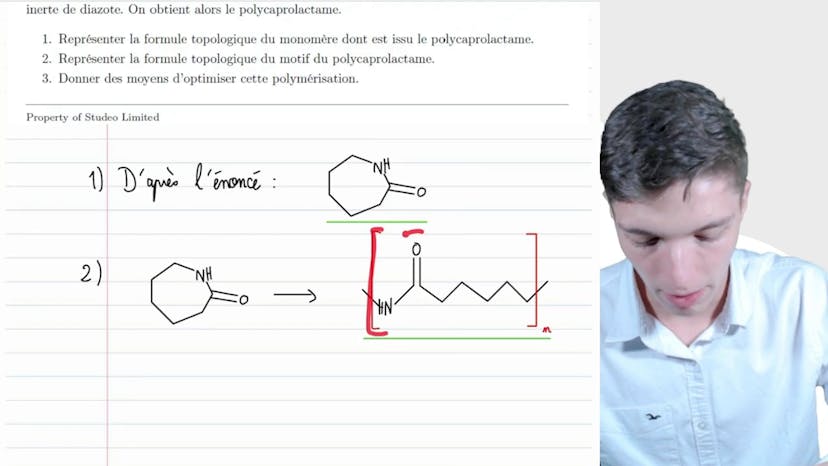
Les lactames
Dans cette vidéo, nous allons nous intéresser à la famille de composés organiques appelés lactames. Les lactames sont caractérisés par la présence d'un groupe amide inclus dans un cycle carboné. Le caprolactame est l'un des composés de cette famille et il est constitué de 7 atomes de carbone dans son cycle, sans autres groupes caractéristiques. Pour obtenir le polycaprolactame, le caprolactame est polymérisé en chaîne par ouverture du cycle au niveau du groupement amide, suivi d'une polycondensation à une température de 269°C et sous atmosphère inerte de diazote. Pour représenter cette transformation, nous pouvons utiliser la formule topologique du monomère, qui montre le groupement amide inclus dans le cycle, ainsi que la formule topologique du polymère, qui illustre l'ouverture du cycle et la chaîne carbonée linéaire. En ce qui concerne les moyens d'optimisation de cette polymérisation, nous pouvons envisager l'utilisation d'un catalyseur, la possibilité de déplacer la réaction si l'un des produits est évacuable, ou l'augmentation de la température pour favoriser la cinétique de la réaction. Merci de nous avoir suivi et à bientôt !
Physique-Chimie
Chimie
Terminale
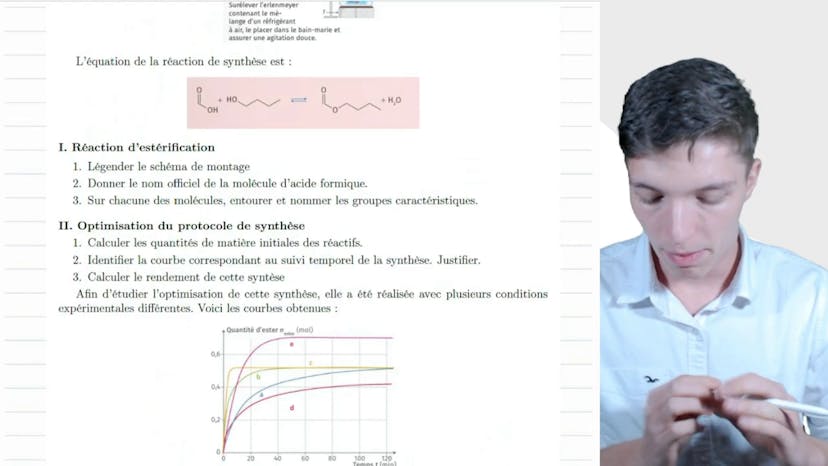
BAC : Estérification
Dans cette vidéo, on aborde la réaction d'estérification. Les esters ont une odeur fruitée et sont utilisés dans l'industrie agroalimentaire et la parfumerie. Certains individus ont une capacité à distinguer les odeurs des esters. En laboratoire, on utilise des méthodes spectroscopiques pour cette réaction.
Le protocole expérimental de cette réaction est illustré par un schéma. On utilise une pipette graduée pour verser le réactif dans l'air laineuse contenant le mélange réactionnel. Le tout est placé dans un bain-marie pour être chauffé et un agitateur magnétique ou mécanique est utilisé pour bien mélanger.
La molécule d'acide formique est l'acide carboxylique utilisé dans cette réaction. Elle est officiellement nommée acide méthanoïque. Les fourmis sécrètent cet acide pour se défendre, d'où son nom.
Dans cette réaction, on identifie différents groupes caractéristiques dans les molécules réactives : le groupement carboxyles, le groupement hydroxyle de l'alcool et le groupement estère.
Pour optimiser cette synthèse, on doit calculer les quantités de matière initiales des réactifs à partir des volumes donnés. On utilise la relation entre la quantité de matière, la masse et le volume pour effectuer ces calculs. On obtient ainsi 0,8 mol d'acide formique et 0,79 mol de butanol.
La courbe correspondant au suivi temporel de la synthèse est identifiée comme étant la courbe C, car les réactifs sont ajoutés à 65°C et dans les proportions stœchiométriques. La quantité d'esters formée, d'après cette courbe, est d'environ 0,5 mol, tandis qu'une réaction totale aurait donné 0,8 mol d'esters. Le rendement de cette synthèse est donc calculé à 63%.
Cet exercice permet de se familiariser avec la réaction d'estérification et ses différentes étapes expérimentales. Il est recommandé de bien comprendre et réviser cet exercice. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

BAC : Détermination d’un protocole
Dans cette vidéo, Matisse de Studio aborde le sujet du protocole de synthèse du méthanoate d'éthyl, qui est utilisé pour donner une odeur de rhum dans l'industrie agroalimentaire. Plusieurs protocoles sont présentés et comparés pour déterminer lequel est le plus optimisé.
Le document 1 présente la réaction de synthèse du méthanoate d'éthyl à partir de l'acide méthanoïque et de l'éthanol. La réaction est lente en l'absence d'un catalyseur.
Les autres documents fournissent des informations sur les propriétés physiques des espèces utilisées, telles que la température d'ébullition et la densité.
Les différents protocoles sont ensuite détaillés. Le protocole 1, qui consiste à mélanger l'éthanol, l'acide méthanoïque et quelques grains de pierre ponce dans un ballon et à chauffer à reflux, ne donne pas de méthanoate d'éthyl. Le protocole 2, qui utilise également de l'acide sulfurique concentré, permet d'obtenir un rendement de 67%. Le protocole 3, qui comprend un excès d'acide méthanoïque, donne des quantités restantes dans le ballon permettant d'évaluer le rendement à 96%. Enfin, le protocole 4, qui utilise un dispositif de chauffage à reflux avec une colonne à distiller, permet d'obtenir un rendement de 97%.
Pour déterminer le protocole idéal, il est nécessaire de comparer les avantages et les inconvénients de chaque protocole en calculant leur rendement respectif. Les protocoles 3 et 4 se révèlent les plus intéressants, avec des rendements de 96% et 97%.
Les comparaisons des protocoles permettent de déduire que l'acide sulfurique concentré est nécessaire comme catalyseur, qu'un excès d'acide méthanoïque améliore le rendement, et que le dispositif de chauffage à reflux utilisé dans le protocole 4 est très efficace.
Finalement, le protocole idéal consiste à réaliser un montage de distillation fractionnée en utilisant 29 mL d'éthanol et 100 mL d'acide méthanoïque. Le milieu est chauffé avec de la pierre-ponce et de l'acide sulfurique concentré, et la température est surveillée. Lorsque la température atteint 55°C et se stabilise, la réaction a évacué le métanoate d'éthyl. Lorsque la température augmente à nouveau, la réaction est stoppée et le distillat contenant le composé recherché est recueilli.
En conclusion, ce cours aborde la façon d'élaborer un protocole de manière optimisée en comparant différents paramètres et en utilisant un critère commun, comme le rendement. L'objectif est d'obtenir le meilleur rendement possible en fonction des critères établis.
Révisions Physique Lycée
Chimie
MPSI/PCSI
Nomenclature
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Squelette et groupe
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Isomérie de constitution
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Le nylon
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Le PET
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Le Rilsan
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Insaturation
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
Les lactames
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
BAC : Estérification
Aucun résumé n'est disponible pour cette vidéo
Révisions Physique Lycée
Chimie
MPSI/PCSI
BAC : Détermination d’un protocole
Aucun résumé n'est disponible pour cette vidéo


