 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Terminale
Première
Seconde
MPSI/PCSI
2BAC SM Maroc
 Tous les sujets
Tous les sujets Maths
Maths Physique-Chimie
Physique-Chimie- Physique
- Chimie
- Physique
- Chimie
TerminaleMPSI/PCSI Corrigés de BAC
Corrigés de BAC Révisions Maths lycée
Révisions Maths lycée Prépa Examens
Prépa Examens
Physique-Chimie
Chimie
Terminale

pH et pKa
Dans cette vidéo, Mathis du studio nous explique les relations entre le pH et le pKa en se concentrant sur l'acide lactique. L'acide lactique se trouve dans le lait, le vin et certains fruits et légumes. Mathis utilise un diagramme de prédominance pour montrer les proportions de AH (l'acide lactique) et A- (ion lactate) en fonction du pH. Il explique que pour déterminer le pH où la concentration en A- est égale à celle de AH, il suffit de trouver l'intersection entre les deux courbes, qui dans ce cas est pH1 = 4. Ensuite, pour trouver le pKa correspondant, il utilise une formule où le pH est égal à pKa plus le log de la concentration en base divisée par la concentration en AH. En utilisant cette formule, il détermine que pKa = 4. Ensuite, il utilise le diagramme de prédominance pour déterminer les proportions d'acide et de base lorsque le pH = 3, soit environ 10% pour A- et 90% pour AH. Enfin, il utilise une autre méthode en utilisant la formule précédente avec les nouvelles valeurs de proportion pour trouver pKa, qui est encore égal à 4. Il souligne que le pKa est une constante qui reste la même quelles que soient les concentrations et les valeurs de pH. Il conclut en disant que comprendre le lien entre le pH et le pKa est crucial pour résoudre de nombreux exercices en chimie.
Physique-Chimie
Chimie
Terminale
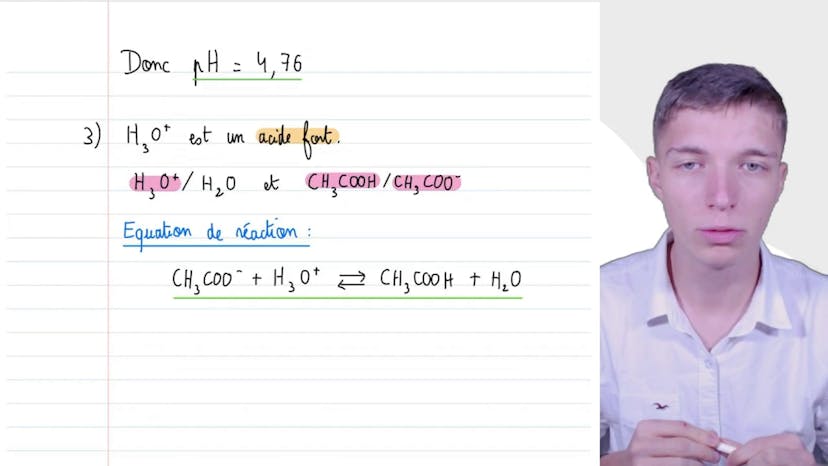
Calculs de pH
Dans cette vidéo, Mathis explique l'évolution du pH en fonction de différentes réactions. Il commence par calculer le pH d'une solution d'acide fort (HCl), en utilisant un tableau d'avancement. Il obtient un pH de 3.
Ensuite, il étudie une solution tampon préparée avec de l'acide éthanoïque (CH3COOH) et de l'éthanoate de sodium (CH3CONA), en utilisant la formule du pH liée au pKa d'un couple acide-base. Il conclut que le pH de la solution tampon est égal au pKa de ce couple, soit 4,76.
Enfin, il analyse l'effet de l'ajout d'ions oxonium (H3O+) sur le pH de la solution tampon. Il écrit l'équation de la réaction acide-base entre les ions oxonium et les ions éthanoate, et utilise à nouveau la formule du pH liée au pKa pour calculer le pH final de la solution tampon, en prenant en compte les différentes concentrations des espèces du couple acide-base. Il obtient un pH final de 4,67.
En résumé, Mathis explique comment calculer le pH d'une solution en utilisant soit la concentration en ions oxonium, soit les concentrations des espèces d'un même couple acide-base. Il souligne également l'impact de l'ajout d'ions auxonium sur l'acidification de la solution.
Physique-Chimie
Chimie
Terminale

Hydrogénosulfate de sodium
Dans cette vidéo, Mathias de Studio explique l'hydrogénosulfate de sodium. Il indique que l'objectif de l'exercice est d'écrire l'équation de dissolution de l'hydrogénosulfate de sodium dans l'eau, l'équation de réaction acide-base de l'ion hydrogénosulfate avec l'eau, et d'exprimer la constante d'acidité du couple acide-base. Il explique également qu'il faut déduire les valeurs des concentrations des espèces chimiques présentes en solution et calculer la constante d'acidité, en se basant sur le pH de la solution qui est de 2,2. Pour résoudre l'exercice, il utilise un tableau d'avancement et détermine les concentrations finales des différentes espèces chimiques en solution. Il conclut en calculant la constante d'acidité (Ka) et en déduisant le pKa. Il souligne l'importance de savoir déterminer l'état d'un système et de comprendre quelles concentrations vont varier, tout en évitant d'oublier les ions spectateurs.
Physique-Chimie
Chimie
Terminale
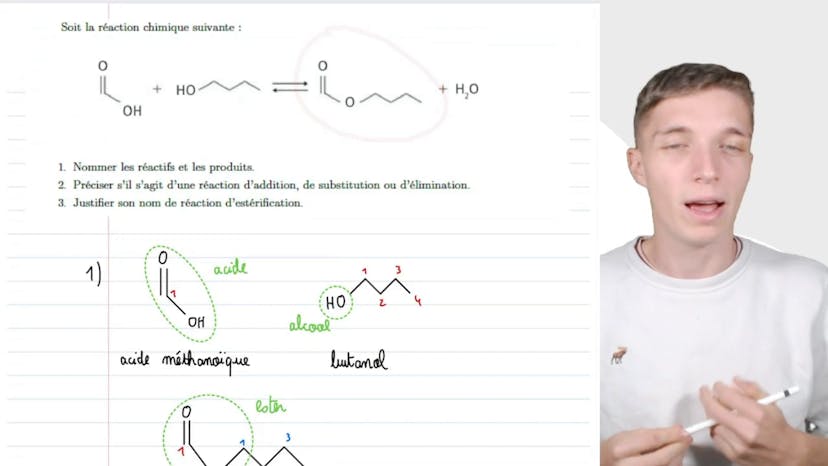
Estérification
Dans cette vidéo, Mathis du studio aborde les stratégies de synthèse, en particulier la réaction d'estérification en chimie organique. Il explique que cette réaction est très importante et intéressante pour les étudiants en prépa. Il commence par nommer les réactifs et les produits de la réaction. Il utilise la méthode de la chaîne carbonée principale et des fonctions pour nommer les molécules. Il explique également que la réaction d'estérification consiste à former un estère à partir d'un acide carboxylique. Il précise que c'est une réaction de substitution car un groupement OH est remplacé par un autre groupement. Enfin, il justifie le nom de la réaction en expliquant qu'elle consiste à former un estère à partir d'un acide carboxylique, d'où le terme "esterification". Il conclut en soulignant l'importance de connaître les mécanismes réactionnels en chimie organique.
Physique-Chimie
Chimie
Terminale

Types de modification
Dans cette vidéo, on aborde les différents types de modifications en chimie organique. On analyse une réaction complexe où une molécule linéaire s'additionne sur elle-même pour former une molécule cyclique. Nous devons identifier les modifications de groupe, de chaîne et de polymérisation. Nous observons ici une formation de cycle, ce qui indique une modification de chaîne carbonée. De plus, les groupements carboxyles sont transformés en groupements carbonyles, ce qui représente une modification de groupe. Il n'y a pas de polymérisation car il n'y a pas d'enchaînement répété de motifs moléculaires. Cette réaction est très importante dans l'enseignement supérieur et il est essentiel de pouvoir analyser les modifications présentes. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Craquage du pentane
Dans cette vidéo, nous allons nous intéresser au craquage du Pintan, une réaction très utilisée dans l'industrie. Cette réaction peut se faire de deux façons : la première réaction donne du propène et un alcane A, tandis que la seconde réaction conduit aux pinènes de Zn et au produit B.
Pour déterminer le nom et la formule des molécules A et B, nous devons mener une petite enquête à partir du Pintan, qui est un alcane linéaire à 5 carbones. La première voie de synthèse nous indique la formation de propène, qui possède 3 atomes de carbone et une double liaison. Il nous manque donc une molécule constituée de 2 carbones et 6 hydrogènes pour obtenir l'alcane A, qui est en réalité l'éthane.
Pour la seconde voie réactionnelle, nous obtenons du pinène 2N et un produit B. Nous n'avons pas d'informations sur B, mais le pinène 2N signifie qu'une double liaison a été formée à partir du carbone 2. Nous avons donc enlevé un hydrogène de chaque carbone, ce qui nous donne un hydrogène unique sur ces deux carbones. Au départ, il y avait 2 hydrogènes sur ces carbones. Ainsi, nous avons formé du pinène, une molécule très intéressante.
Il est important de noter que la chaîne carbonée est modifiée dans la première réaction, passant d'une chaîne carbonée à 5 carbones à deux molécules ayant des chaînes carbonées de 3 et 2. Dans la seconde réaction, la chaîne carbonée n'est pas modifiée, seulement deux hydrogènes sont enlevés.
Cette réflexion globale sur les modifications de la chaîne et du groupe fonctionnel est essentielle pour comprendre ce type de réaction. Merci de nous avoir suivi et à bientôt !
Physique-Chimie
Chimie
Terminale
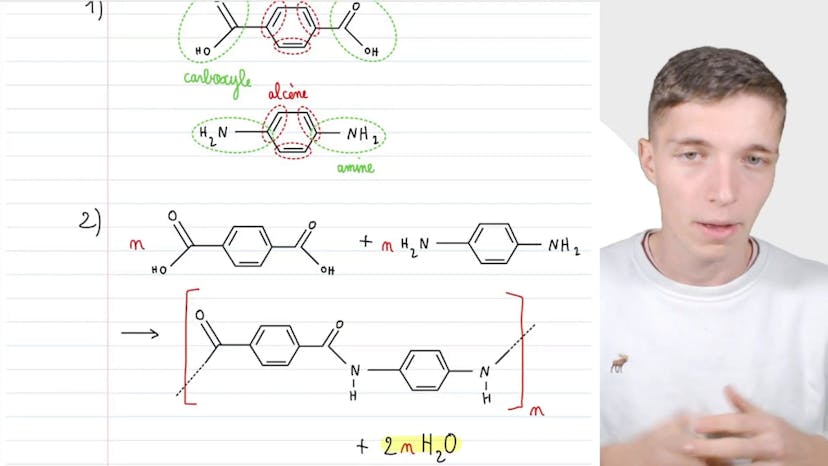
Kevlar
Dans cette vidéo, Matisse de Studio nous présente la synthèse du Kevlar, qui est un polymère artificiel également connu sous le nom de polypénylène terephthalamine. Les deux monomères utilisés dans la stratégie de synthèse de ce polymère sont constitués de groupes caractéristiques tels que des groupes carboxyles (COOH), des doubles liaisons entre des carbones (alcènes) et des amines (NH2). La réaction de synthèse du polymère est une polycondensation, dans laquelle les deux monomères s'assemblent pour former la chaîne répétée du polymère. L'azote de l'un des monomères remplace l'oxygène de l'autre monomère pour former des amides. L'équation de la réaction montre également que deux molécules d'eau sont produites. Il est important de bien identifier les groupes caractéristiques présents dans les monomères pour comprendre le mécanisme réactionnel et la structure du polymère final. Merci d'avoir suivi cette vidéo et à bientôt!
Physique-Chimie
Chimie
Terminale
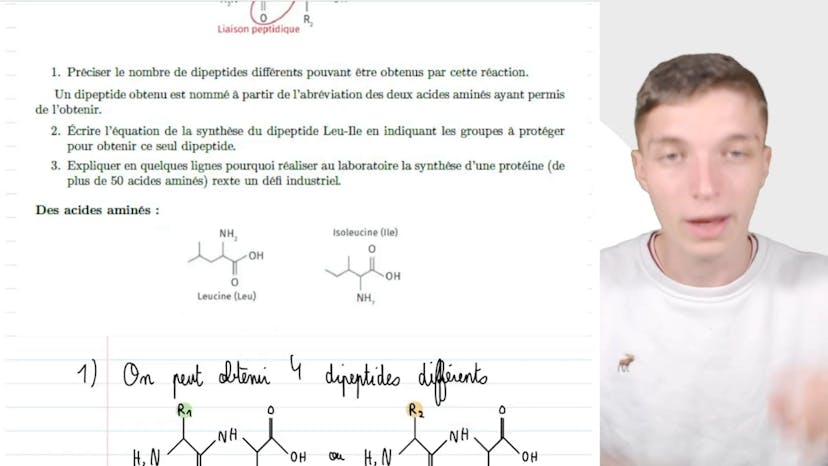
Synthèse des protéines
La synthèse des protéines en laboratoire est réalisée par les chimistes en utilisant la réaction de synthèse peptidique. Cette réaction combine deux molécules d'acides aminés en formant des liaisons peptidiques. On peut obtenir jusqu'à 10 peptides différents par cette réaction en combinant les groupements R1 et R2 des deux molécules. Cependant, il faut prendre en compte la possibilité de réaction intra-moléculaire, ce qui augmente le nombre de peptides possibles à 4.
Pour obtenir un dipeptide spécifique, il est nécessaire de protéger certains groupements des acides aminés afin d'éviter des réactions indésirables. Par exemple, pour obtenir le dipeptide EU-IL, il faut protéger le groupement NH2 de l'acide aminé EU et le groupement COOH de l'acide aminé IL. Ainsi, seule la réaction entre ces deux acides aminés aura lieu.
La synthèse d'une protéine de plus de 50 acides aminés reste un défi industriel en raison de la complexité de la protection et de la déprotection sélective des groupements pendant la réaction. Il faut une extrême précision et une sélectivité élevée pour obtenir un enchaînement d'acides aminés spécifique. Ce défi augmente avec la taille de la protéine, ce qui rend la synthèse de protéines de grande taille difficile à réaliser en laboratoire.
Physique-Chimie
Chimie
Terminale

Synthèse des protéines bis
Dans cette vidéo, Matisse de Studio parle de la synthèse de protéines en se concentrant sur les acides alpha-aminés leucine et alanine. Il explique que ces deux acides ont des groupes carboxyle et amine portés par le même carbone, ce qui les rend alpha-aminés. On peut former des isons peptidiques en faisant réagir ces acides dans les bonnes conditions. La première question est de déterminer les dix peptides possibles. On peut réagir la leucine sur l'alanine et vice versa, ce qui nous donne les peptides ala-leu et leu-ala. On peut également former des peptides ala-ala et leu-leu, car les acides alpha-aminés peuvent réagir sur eux-mêmes. Il faut ensuite déterminer les groupes à protéger pour synthétiser le peptide donné. On veut que le groupe amine de la leucine réagisse avec le groupe carboxyle de l'alanine, mais pas que le groupe carboxyle de la leucine réagisse avec le groupe amine de l'alanine. Donc, il faut protéger le groupe amine de la leucine et le groupe carboxyle de l'alanine. Cela permet d'empêcher ces groupes de réagir avec l'extérieur. En comprenant quelles réactions on souhaite garder et quelles réactions on souhaite provoquer, on peut obtenir la molécule désirée. Merci d'avoir suivi cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale

Acide benzoïque
Dans cette vidéo, Matisse de Studio explique la synthèse de l'acide benzoïque, un conservateur utilisé dans de nombreuses boissons sans alcool. Le processus de synthèse comprend plusieurs étapes. Tout d'abord, l'alcool benzilique est oxydé en présence de permanganate en excès, formant des ions benzoates et du dioxyde de manganèse. Ensuite, les ions permanganates excédentaires sont réduits par l'éthanol, éliminant ainsi le MnO2 et donnant une solution incolore contenant les ions benzoates. Pour obtenir l'acide benzoïque souhaité, il faut ensuite ajouter de l'acide chlorhydrique à cette solution, ce qui permet la cristallisation de l'acide benzoïque sous forme de solides blancs.
L'étape suivante consiste à nommer les étapes de la synthèse et à expliquer leur utilité. L'oxydation de l'alcool benzilique permet de former les ions benzoates, qui sont ensuite extraits du mélange. L'acidification du milieu permet de transformer les ions benzoates en acide benzoïque.
Ensuite, les demi-équations lors de la synthèse des ions benzoates sont écrites. L'alcool benzilique réagit avec l'eau pour former les ions benzoates, et les ions permanganates se transforment en dioxyde de manganèse. En équilibrant ces demi-équations, on obtient l'équation bilan de la réaction.
Enfin, on analyse la transformation qui conduit à la cristallisation de l'acide benzoïque. L'ajout d'acide chlorhydrique acidifie le milieu et transforme les ions benzoates en acide benzoïque, ce qui correspond à une réaction acide-base.
En résumé, cette vidéo explique de manière détaillée la synthèse de l'acide benzoïque en utilisant des termes compréhensibles pour le référencement SEO.
Physique-Chimie
Chimie
Terminale

Analyse de synthèses
Dans cette vidéo, nous analysons une synthèse chimique qui consiste à remplacer un groupe hydroxyle de la molécule A par un groupement cyano-CN. La première étape consiste à protéger les deux premiers groupements hydroxyles afin qu'ils ne soient pas affectés par la réaction ultérieure. Ensuite, l'attaque par CN se fait uniquement sur le groupe hydroxyle restant. Une fois que la réaction de substitution est terminée, les deux premiers groupements hydroxyles sont déprotégés. Ces étapes de protection et de déprotection sont nécessaires pour atteindre l'objectif de substitution d'un seul groupe hydroxyle. Si ces groupements n'étaient pas protégés, ils seraient également substitués par le groupement cyano-CN et l'objectif ne serait pas atteint. Cette approche de la chimie organique permet de contrôler les réactions et d'obtenir les résultats souhaités. Merci d'avoir regardé cette vidéo et à bientôt !
Physique-Chimie
Chimie
Terminale
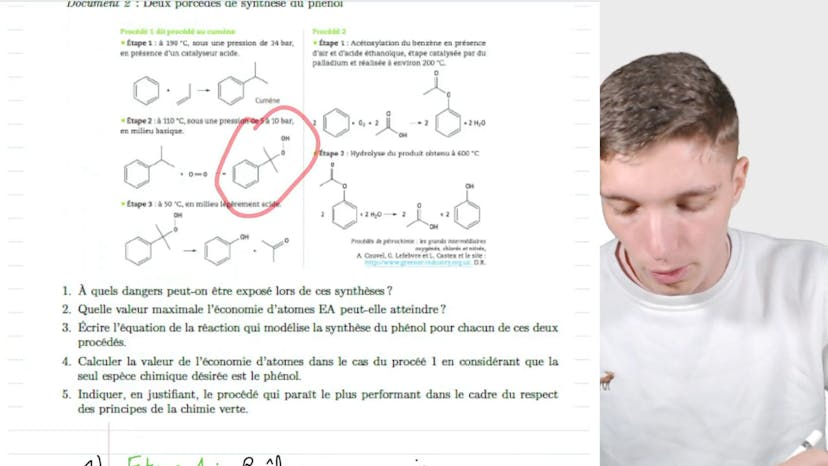
BAC : Chimie verte
Dans cette vidéo, Matisse de Studio aborde le sujet de la chimie verte et se concentre sur la synthèse du phénol en comparant deux procédés du point de vue de la chimie verte. Il explique que la chimie verte est un concept souvent présent dans les exercices de physique-chimie à la fin du bac, où l'on nous présente des notions nouvelles auxquelles on doit s'adapter.
Il introduit tout d'abord le concept d'économie d'atomes, qui mesure l'efficacité d'un procédé en termes d'utilisation atomique. Il explique la formule mathématique qui permet de calculer l'économie d'atomes et souligne que les procédés verts ne sont pas seulement moins polluants, mais permettent également de réduire les dépenses.
Ensuite, il présente deux procédés de synthèse du phénol et analyse les dangers auxquels on peut être exposé lors de ces synthèses en se basant sur les conditions dans lesquelles elles sont réalisées.
Il répond ensuite à plusieurs questions. La première concerne les dangers lors des synthèses. Il indique que l'étape 1 présente des risques de brûlure et de surpression, l'étape 2 présente des risques de corrosion et l'étape 3 présente des risques de brûlure et de corrosion.
La deuxième question porte sur la valeur maximale de l'économie d'atomes. Il explique que la valeur maximale est de 1, car la réaction est équilibrée.
La troisième question demande d'écrire l'équation de la réaction pour chaque procédé. Il explique qu'il faut prendre en compte les réactifs et les produits des différentes étapes intermédiaires et montre les équations correspondantes.
La quatrième question demande de calculer l'économie d'atomes pour le procédé 1 en considérant que seule l'espèce chimique désirée est le phénol. Il applique la formule aux réactifs et produits de la réaction du procédé 1 et obtient un score de 0,62. Il conclut en expliquant que le procédé 2 est le plus performant en terme de chimie verte car il ne produit que le produit désiré, contrairement au procédé 1 qui produit une espèce indésirable.
En résumé, cette vidéo aborde le sujet de la chimie verte et compare deux procédés de synthèse du phénol du point de vue de l'économie d'atomes. Elle met en évidence l'importance de réduire les impacts environnementaux et les coûts dans les procédés chimiques industriels.


